2023年,中国创新药license out交易金额和交易数量再创新高。根据医药魔方数据库,今年国内共发生了近70笔创新药license out交易,已披露交易总金额超350亿美元。(注:数据截至发稿日期,本文仅统计国内转国外创新药交易,技术平台等未统计)
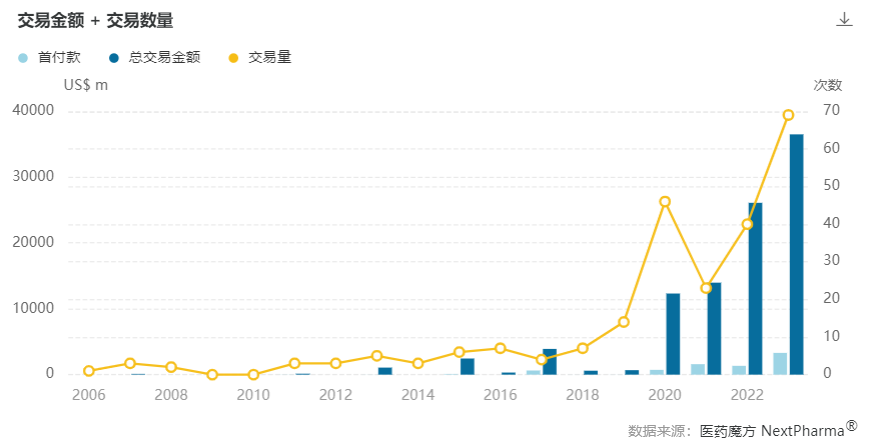
本文按已披露总金额和首付款整理了2023年中国创新药license out交易TOP15榜单,如下图所示。
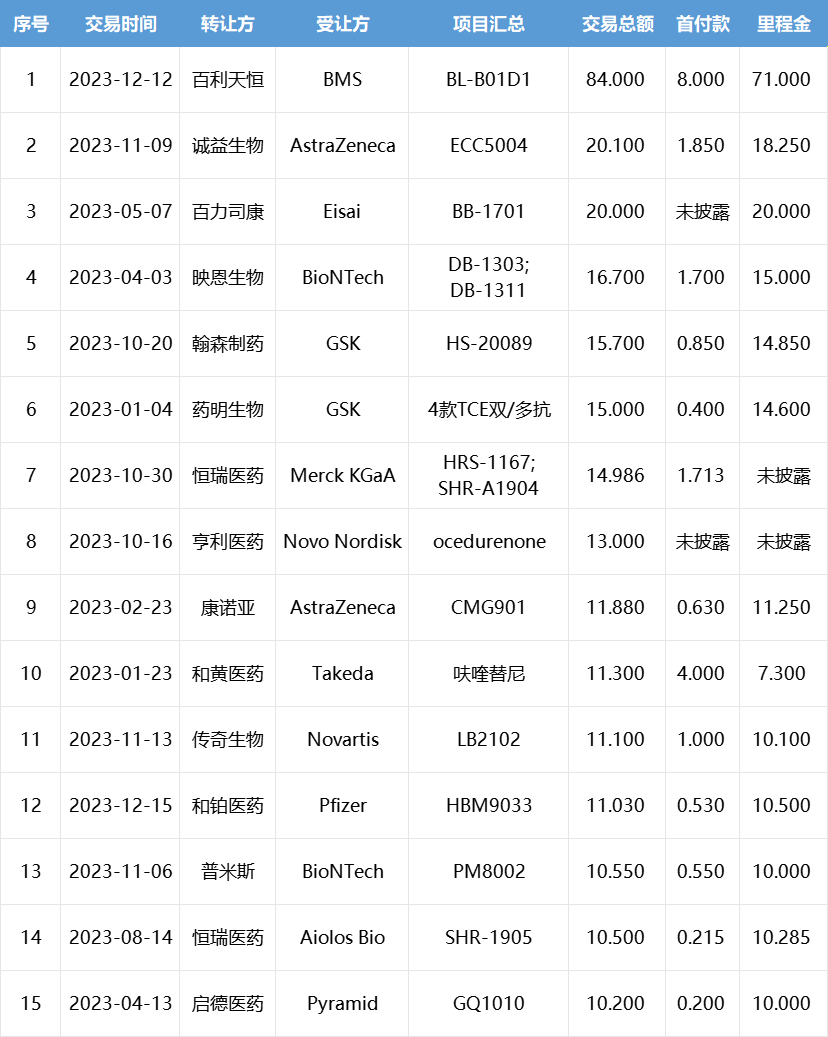
2023年中国创新药license out交易TOP15
(按总金额计,单位:亿美元)
2023年中国创新药license out交易TOP15
(按首付款计,单位:亿美元)
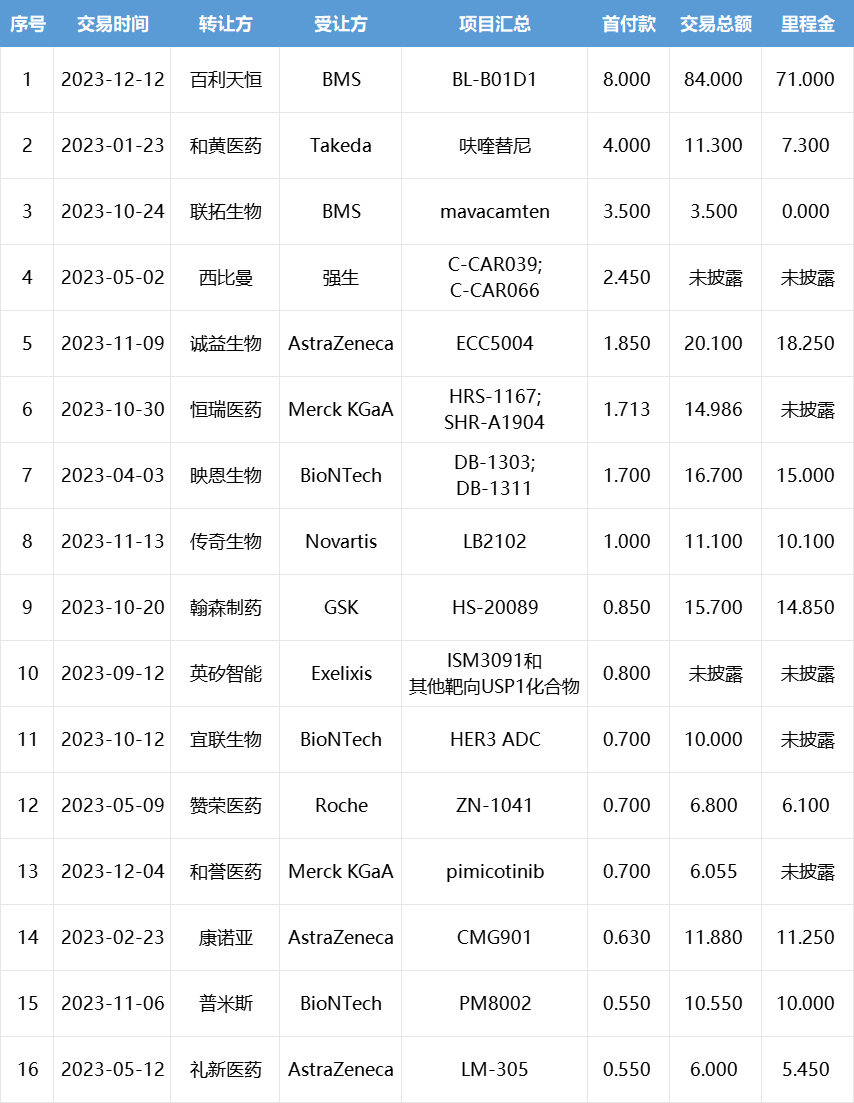
今年TOP15(按总金额)上榜门槛为10.2亿美元,是去年(2.58亿美元)的4倍。此外,抗体偶联药物(ADC)成为授权最多的药物类型,榜单中有8笔交易涉及ADC,交易总金额超过180亿美元。
从公司来看,MNC是国内药企首选的合作对象,其中阿斯利康、GSK等公司扫货最为频繁。恒瑞医药、翰森制药等传统药企开始在license out方面发力,接连成功将产品授权出去。
下文将按照总金额具体介绍今年中国创新药license out交易TOP15案例,供参考。
NO.1 百利天恒HER3/EGFR双抗ADC授权BMS
12月11日,百利天恒宣布,与BMS达成协议,将其HER3/EGFR双抗ADC产品BL-B01D1的开发和商业化权益授权后者,交易总额高达84亿美元,包括8亿美元预付款、5亿美元潜在近期付款和71亿美元里程金。
根据协议条款,两家公司将在美国联合开发和商业化BL-B01D1。百利天恒全权负责其在中国大陆的开发、商业化和生产,并负责生产在中国大陆以外使用的药品。BMS全权负责在全球其他地区的开发和商业化。
BL-B01D1是百利天恒根据HER3/EGFR双抗SI-B001开发的双抗ADC,目前处于III期研究阶段,小分子毒素部分为其自主研发的喜树碱衍生物ED04,DAR值为8。
NO.2 诚益生物小分子GLP-1受体激动剂授权阿斯利康
11月9日,诚益生物宣布,与阿斯利康达成一项独家许可协议,将小分子GLP-1受体激动剂(GLP-1RA)ECC5004的开发和商业化权益授予后者,用于包括肥胖症、2型糖尿病和其他合并症的潜在治疗。根据协议条款,诚益生物将获得1.85亿美元的首付款、高达18.25亿美元的未来临床、注册和商业化里程碑付款,以及净销售额的分级特许权使用费。
ECC5004是一款每日一次、低剂量、小分子GLP-1受体激动剂,目前正在美国进行针对健康受试者和2型糖尿病(T2D)患者的I期临床试验。ECC5004已在临床前研究中证明具有令人满意的疗效和安全性。
NO.3 百力司康HER2 ADC授权卫材
5月8日,百力司康与卫材就HER2 ADC BB-1701达成联合开发协议,后者拥有战略合作的选择权。
根据协议条款,卫材将向百力司康支付预付款和开发里程碑付款,进行乳腺癌的II期临床试验,并获得在全球范围内(除大中华区)开发和商业化BB-1701的选择权。如果卫材行使选择权,将向百力司康支付一笔额外预付款、最高20亿美元里程碑付款以及特许权使用费。
BB-1701是一款由百力司康开发的由HER2抗体和艾立布林结合的ADC,具有独特的作用机制,包括有效的旁路杀伤效应以及免疫原性细胞死亡活性。
NO.4 映恩生物2款第三代ADC授权BioNTech
4月3日,映恩生物宣布,与BioNTech就两款抗体偶联药物(ADC)管线DB-1303及DB-1311达成独家许可和合作协议,将其在全球(不包括中国大陆、香港和澳门)的开发、生产和商业化的权益授权给后者。根据协议条款,映恩生物将获得1.7亿美元首付款,并有望获得总金额超过15亿美元的开发、注册和商业化里程碑付款,以及特许权使用费。此外,映恩生物拥有未来就美国市场行使共同开发和销售DB-1311的选择权。
DB-1303是基于映恩生物独创DITAC技术平台开发的第三代HER2 ADC产品,由拓扑异构酶-1抑制剂P1003 、可裂解连接子和靶向HER2的抗体组成,DAR值约为7-8 。DB1303 在HER2阳性和HER2低表达的肿瘤模型中均表现出强大的抗肿瘤活性、优异的安全性及较宽的治疗窗口。
DB-1311也是基于映恩生物DITAC技术平台开发的第三代ADC产品,由靶向B7-H3的抗体, 拓扑异构酶-1抑制剂、可裂解连接子组成,DAR值为6。DB1311 在代表多种癌症类型的一系列肿瘤模型中显示出强大的抗肿瘤活性,并且在临床前安全评估中展现出良好的耐受性和良好的药代动力学特征。
NO.5 翰森制药B7-H4 ADC授权GSK
10月20日,翰森制药与GSK达成协议,将B7-H4 ADC HS-20089除中国外的全球开发和商业化权益独家授权给后者。翰森制药将收取8500万美元首付款、最多14.85亿美元里程碑付款,以及特许权使用费。
HS-20089是一种新型B7-H4靶向ADC,目前正在中国进行用于治疗妇科癌症的I期临床研究。除了靶向在卵巢癌和子宫内膜癌中过度表达且通常与预后不良有关的B7-H4表面抗原外,HS-20089还采用了经临床验证的ADC技术,即拓扑异构酶抑制剂(TOPOi)有效载荷。
NO.6 药明生物多款TCE双抗/多抗授权GSK
1月4日,药明生物宣布,与GSK达成许可协议,将其专利技术平台开发的至多四款TCE双特异性/多特异性抗体的独家权利授权给后者。药明生物将获得4000万美元首付款和最高达14.6亿美元的4款TCE抗体的里程碑付款,以及销售提成。
据悉,GSK将获得1款处于临床前阶段的双抗和其他至多3款处于早期发现阶段的TCE抗体的全球独家研究、开发、生产和商业化权益。该双抗分别靶向肿瘤细胞表面的肿瘤相关抗原(TAA)和T细胞表面抗原CD3,通过与肿瘤细胞及T细胞结合,特异性激活T细胞,从而杀伤肿瘤细胞,产生抗肿瘤活性。
NO.7 恒瑞医药2款新药授权默克
10月30日,恒瑞医药宣布,与默克达成协议,将其自主研发的PARP1抑制剂HRS-1167在中国大陆以外的全球权益独家许可给后者。此外,默克还拥有恒瑞Claudin-18.2 ADC SHR-A1904的独家选择权,HRS-1167和SHR-A1904在中国大陆与恒瑞医药共同商业化的选择权。根据协议条款,恒瑞医药将获得1.6亿欧元首付款、高至9000万欧元的技术转移费和行权费,以及研发、销售里程碑付款,总额可能高达14亿欧元。恒瑞医药还有权获得销售提成。
HRS-1167是一款选择性、高活性、可口服的PARP1小分子抑制剂。PARP是修复DNA损伤的关键,与第一代PARP抑制剂相比,HRS-1167对PARP1的选择性更高、亲和力更强,且可诱导DNA捕获。HRS-1167目前处于早期临床开发,有潜力作为单一疗法和联合疗法治疗更多患者。
SHR-A1904是一款靶向Claudin 18.2的ADC,通过与肿瘤细胞表面的靶抗原结合,使得药物被内吞进入细胞后释放小分子毒素杀伤肿瘤细胞。该产品当前正在中国、美国、澳大利亚进行临床I期试验。
NO.8 亨利医药向诺和诺德出售高血压新药
10月16日,诺和诺德宣布,鉴于ocedurenone在心血管及肾脏疾病领域未控制高血压的应用潜力,决定以至多13亿美元从亨利医药收购该产品。
Ocedurenone是一种口服、小分子、非甾体盐皮质激素受体拮抗剂(nsMRA),目前正通过III期试验CLARION-CKD在未控制高血压患者和晚期慢性肾病(CKD)患者中进行验证。未控制高血压是指患者在接受两种或更多降血压治疗后血压仍然较高的情况。
NO.9 康诺亚Claudin 18.2 ADC授权阿斯利康
2月23日,康诺亚宣布,其非全资附属公司KYM Biosciences(康诺亚拥有70%权益)与阿斯利康签署全球独家许可协议,将CMG901研究、开发、注册、生产及商业化的全球权益授权给后者。KYM将收取6300万美元预付款、最多11.25亿美元的额外潜在付款,以及分级特许权使用费。
CMG901为康诺亚与乐普生物共同开发的Claudin 18.2 ADC,由Claudin 18.2特异性抗体、可裂解连接子及毒性载荷、一甲基澳瑞他汀E(MMAE)组成。Claudin 18.2于胃癌、胰腺癌及其他实体瘤中的表达呈高度选择性及广泛性,是肿瘤治疗的理想靶点。
NO.10 和黄医药VEGFR抑制剂授权武田
1月23日,和黄医药与武田制药达成独家许可协议,授予或者在除中国内地、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。和黄医药将获得总额高达11.3亿美元的付款,包括4亿美元首付款,以及潜在的监管注册、开发和商业销售里程碑付款,特许权使用费。
呋喹替尼是一种高选择性、强效的血管内皮生长因子受体 (VEGFR)-1、-2及-3抑制剂。呋喹替尼可通过口服给药,并有潜力用于转移性结直肠癌的各种亚型中且不受生物标志物状态影响。今年11月,该产品成功获FDA批准上市,用于治疗经治转移性结直肠癌。
NO.11 传奇生物DLL3 CAR-T授权诺华
11月13日,传奇生物宣布与诺华就其DLL3 CAR-T疗法达成了独家全球许可协议,包括自体实体瘤CAR-T细胞疗法LB2102。诺华获得开发、制造和商业化这些细胞疗法的全球独家权利,诺华可以用其T-Charge™平台进行生产。
根据协议条款,传奇生物将获得1亿美元的预付款,并有资格获得高达10.1亿美元的临床、监管和商业里程碑付款以及分级特许权使用费。
NO.12 和铂医药MSLN ADC授权辉瑞
12月15日,和铂医药全资子公司诺纳生物宣布,与辉瑞就靶向人间皮素(MSLN)抗体偶联药物(ADC)HBM9033 的全球临床开发和商业化签订独家授权协议。根据协议,诺纳生物将获得5300万美元预付款和近期付款,最高达 10.5 亿美元的里程碑付款,以及分级特许权使用费。
HBM9033是一款MSLN ADC,其全人源单克隆抗体(mAb)由HarbourMice平台产生,具有良好的特性,可保持与膜结合型MSLN的强结合和内化同时减少与游离型MSLN的结合。独特的抗体设计使其在各种具有不同MSLN表达水平的临床前肿瘤模型研究中展现出卓越的疗效和安全性,从而使HBM9033成为潜在的全球同类最佳治疗方案。
NO.13 普米斯PD-L1/VEGF双抗授权BioNTech
11月6日,普米斯宣布与BioNTech达成许可合作协议,将抗PD-L1/VEGF双抗PM8002在全球(大中华区除外)的开发、生产和商业化权利授予后者。普米斯将获得5500万美元首付款,以及超10亿美元的开发、注册和商业里程碑付款以及分级销售提成。
PM8002是一款双特异性抗体候选药物,由人源化的抗PD-L1单域抗体(VHH)融合到一个含有Fc-沉默突变的抗VEGF-A IgG1抗体上构成。通过PD-L1将PM8002分子富集到肿瘤环境中,从而降低全身性阻断VEGF所导致的系统性副作用。目前PM8002正在中国开展II期临床研究,评估该药物作为单一疗法或与化疗联合治疗实体瘤患者的疗效和安全性。
NO.14 恒瑞医药TSLP单抗授权One Bio
8月14日,恒瑞医药宣布已与美国One Bio公司达成合作协议,将具有自主知识产权的1类新药SHR-1905注射液项目除大中华区以外的全球范围内开发、生产和商业化的独家权益授授予后者。恒瑞医药将获得2500万美元首付款和近期里程碑付款、10.25亿美元研发及销售里程碑款以及一定比例的销售分成。
SHR-1905为恒瑞自主研发且具有知识产权的胸腺基质淋巴细胞生成素(TSLP)单克隆抗体,可以阻断炎症细胞因子的释放,抑制下游炎症信号的传导,最终改善炎症状态并控制疾病进展。由于TSLP作用于炎症级联反应的早期上游,SHR-1905有潜力适用于广泛的重度哮喘,不受表型(嗜酸性或过敏等)以及生物标志物的限制,因此相较其他靶点药物具有更大的市场潜力。此外,基于差异化的分子设计,SHR-1905有望成为同类最佳。
NO.15 启德医药TROP2 ADC授权Pyramid
4月13日,启德医药宣布已与Pyramid Biosciences签订独家许可协议,授予后者在大中华区以外开发和商业化GQ1010。启德医药有资格获得2000万美元的预付款和高达10亿美元的额外里程碑付款,以及中个位数到低两位数不等的分级销售提成。
GQ1010是一款TROP2 ADC,利用了一种独特的位点特异性偶联技术,以及新型连接子-有效载荷,这可能会提高ADC的稳定性、安全性和效力。临床前数据表明,与现有TROP2 ADC相比,GQ1010具有更大的治疗范围,这可能使GQ1010的具有更好的疗效和安全性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..