2024年6月1日,宜联生物在2024年美国临床肿瘤学会(ASCO)年会上以壁报形式报告了YL202的临床数据,这是宜联生物自成立以来的首次临床数据公开。YL202为靶向HER3的ADC,基于宜联TMALIN平台所设计。此前,宜联生物已就该产品与BioNTech达成海外合作授权,BioNTech向宜联生物支付7000万美元首付款及潜在超10亿美元总付款,获得YL202海外开发、制造和商业化的独家权利。
此次报告标题为“YL202/BNT326, a HER3-targeted ADC, in patients with locally advanced or metastatic non-small cell lung cancer and breast cancer: Preliminary results from a first-in-human phase I trial”。截至2024年4月16日,该项中、美同步开展的I期临床爬坡共计入组55人(非小细胞肺癌40人,乳腺癌15人),累计爬坡7个剂量组(0.5 – 5.5 mg/kg Q3W)。其中,NSCLC入组EGFR突变人群,既往经历过3代TKI、铂类化疗、以及PD-L1治疗;BC入组HR+/HER2-人群,既往经历过内分泌治疗伴CDK4/6抑制剂,以及1-2线化疗。
疗效方面,全部剂量下共51例可评估病例,ORR为42.3%,DCR为94.2%,mPFS为6.0月,mDOR为5.8月;其中3.0mg/kg剂量组ORR为60.0%,DCR为100%。在EGFRm NSCLC末线人群中,全部爬坡剂量下ORR为39.4%(15/38);在HR+/HER2- BC末线人群中,全部爬坡剂量下ORR为53.8%(7/13)。值得一提的是,在最低剂量组(0.5mg/kg)下即观察到PR响应,在组治疗时间达14个月并仍在持续中。这种疗效表现一定程度上体现了宜联TMALIN平台(下图)的技术特色。
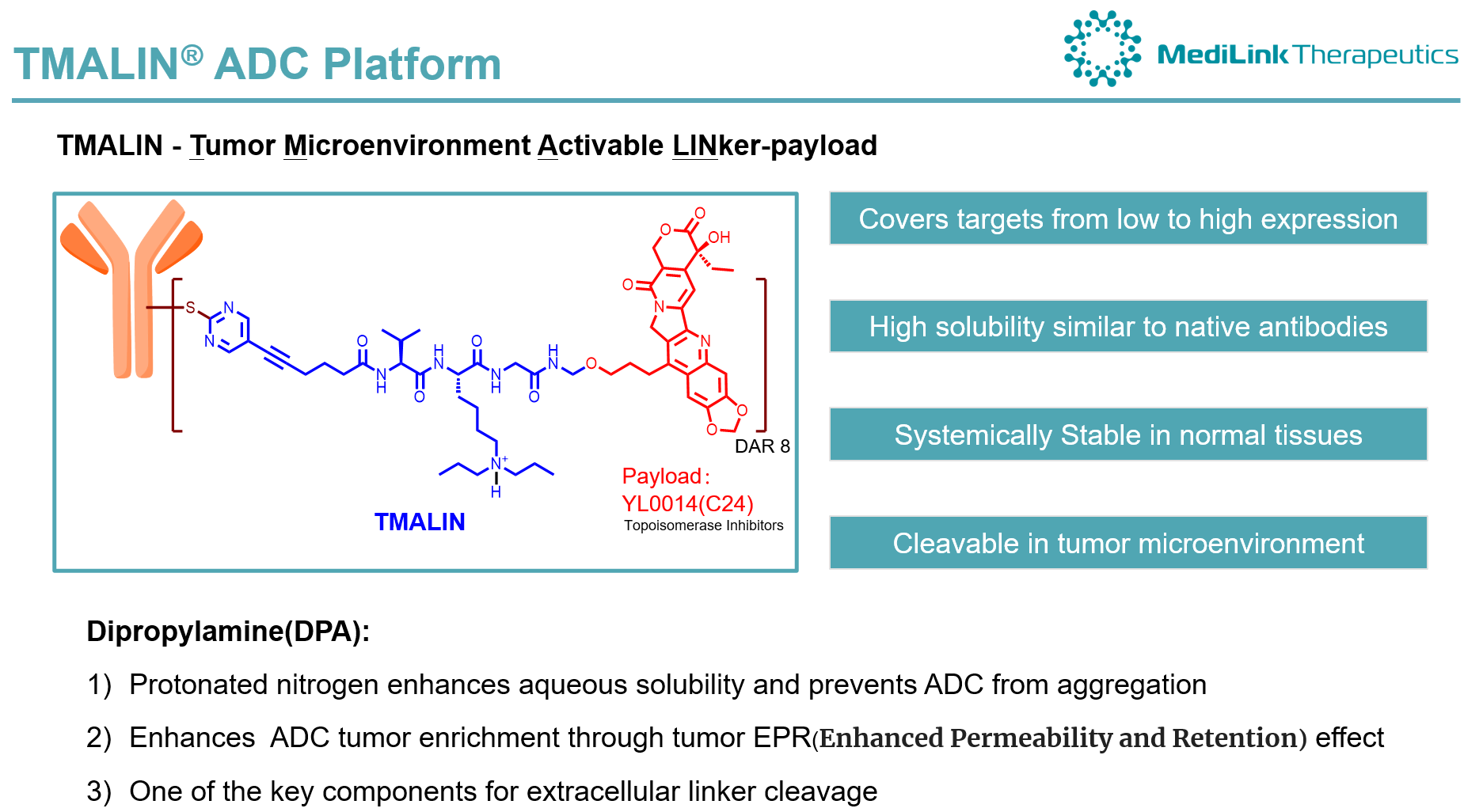
安全性方面,常见治疗相关安全事件包括白细胞计数减少(40%),中性粒细胞减少(31%)等血液学副作用。在爬坡过程中,5.5mg/kg剂量组下出现一例DLT事件(三级粒缺伴发热)。在回填过程中,4.0mg/kg和5.5mg/kg剂量组下分别出现2例(中性粒和血细胞减少)和1例受试者死亡(新冠感染后间质性肺炎)。基于以上剂量探索观察,该研究在结论中指出后续将着重于4.0mg/kg以下剂量开展YL202的进一步开发。
与全球研发进度最领先的HER3 ADC药物U3-1402相比,宜联YL202有望展现出Best-in-class及First-in-disease的潜质。从响应率来看,YL202全部爬坡剂量ORR为42.3%,其中3.0mg/kg ORR为60.0%。分适应症来看,全部爬坡剂量下YL202在EGFRm NSCLC的ORR为39.4%,HR+/HER2- BC的ORR为53.8%。数值明显优于U3-1402相应表现(非头对头)。在U3-1402即将申报上市的EGFRm NSCLC适应症中,ORR为29.8%,PFS为5.5个月。乳腺癌方面,U3-1402则并未重点布局(或是第一三共在拥有DS-8201、Dato-Dxd情况下,出于整体管线策略考虑)。而据公开信息显示,YL202已启动HR+/HER2- BC的II期临床研究,有望在全球范围内占得先机。
总结
宜联生物基于其技术平台打造了丰富的ADC管线。自有管线方面,B7H3 ADC、HER3 ADC(大中华区)处于临床II期,NaPi2b ADC处于临床I期,此外还有数款临床前阶段的管线。外部合作方面,宜联的TMALIN技术平台得到广泛的国际认可,基于此实现了多起授权出海合作协议。其中HER3 ADC(海外)授权给BioNTech,cMET ADC授权给罗氏,前不久又与BioNTech达成18亿美元技术授权合作。除此外,国内多家生物技术公司获得宜联生物技术授权开发ADC新药,包括再鼎医药的DLL3 ADC,和铂医药的MSLN ADC(与辉瑞子公司Seagen达成授权出海协议),以及复宏汉霖的EGFR ADC和PD-L1 ADC。此次是宜联首次公布其ADC管线临床数据,创新技术平台开始在临床端兑现其差异化设计的优势,期待其后续更多临床进展,尤其是首发管线B7H3 ADC的临床表现。近一两年来,国产ADC吸引了全球制药界的关注,BD、并购交易频发,也期待更多的国产ADC陆续释放扎实、优异的数据。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..