尽管目前全球尚无双靶点CAR-T获批上市,但一批企业对双靶点CAR-T产品寄予厚望,包括传奇生物、亘喜生物、驯鹿医疗等。
文丨笃行
近日,西比曼生物科技宣布,FDA授予公司细胞治疗产品C-CAR039再生医学先进疗法(RMAT)资格和快速通道(FT)资格,用于治疗复发或难治性及弥漫性大B细胞淋巴瘤(r/r DLBCL)。C-CAR039是一种新型第二代4-1BB双靶点CAR-T,同时作用于CD19和CD20双靶点,可以在体内和体外有效清除CD19/CD20单阳性或双阳性肿瘤细胞。
目前,FDA已批准5款CAR-T细胞疗法上市,NMPA批准2款CAR-T细胞疗法上市,上市的CAR-T细胞疗法均为单靶点CAR-T细胞疗法,尚无双靶点CAR-T细胞疗法获批上市。但考虑到恶性肿瘤复杂的发病机制,针对单一靶点的CAR-T疗法可能无法表现出足够的治疗效果,因此研究人员将目光投向了双靶点CAR-T细胞疗法,这与双抗的诞生有异曲同工之妙。
1
双靶点CAR-T概述
在国内癌症患者人数持续增长及支付能力不断提升的背景下,CAR-T细胞疗法凭借其疗效优势被寄予厚望。从机制的角度,CAR-T产品可以以非MHC限制性的方式识别和杀伤肿瘤细胞,靶向性克服免疫逃逸,因此疗效有望超越单抗、双抗、ADC等产品。据弗若斯特沙利文的预测,2022年中国CAR-T细胞疗法市场规模有望达到15亿元,到2024年有望增长至53亿元,到2030年有望实现239亿元的市场规模。
图:中国CAR-T细胞疗法市场的预测市场规模 (十亿元)
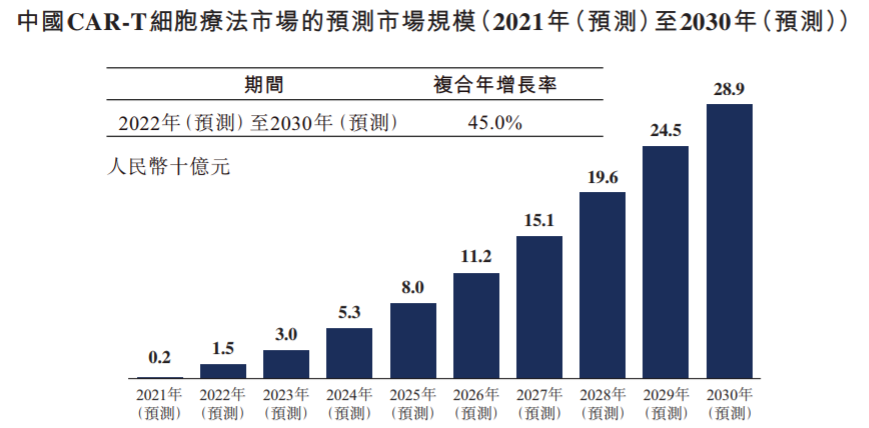
数据来源:弗若斯特沙利文
尽管单靶点CAR-T产品目前在临床研究中已显示出良好的疗效,但仍有部分患者在接受CAR-T治疗后出现疾病进展或复发,有观点认为疾病的进展或复发的根本原因在于肿瘤细胞表面特定靶点的丢失或表达的减少。因此通过增加一个结合位点,即同时靶向两个抗原或抗原的不同表位,双特异性靶点CAR-T有望提升治疗的特异性,更加准确地靶向肿瘤细胞并降低脱靶毒性,从而增强肿瘤细胞的杀伤毒性。
2
双靶点CAR-T布局
尽管目前全球尚无双靶点CAR-T获批上市,但一批企业对双靶点CAR-T产品寄予厚望。从靶点的选择上,CD19×CD22 CAR-T是关注度最高的靶点组合,驯鹿医疗、恒润达生、森朗生物等企业深耕于此,传奇生物还布局了独有的CD19×CD20×CD22三靶点产品;此外,CD19×BCMA CAR-T产品的研发浪潮亦此起彼伏,吸引了一批国内制药企业布局。
(1)CD19×CD22 CAR-T:CD19和CD22均特异性表达于多种B细胞肿瘤表面。目前,全球已有多款CD19 CAR-T获批上市,但有研究发现部分B细胞肿瘤患者接受了CD19 CAR-T治疗后仍会出现疾病的进展和复发。原因在于一些原本表达CD19的肿瘤细胞面对CAR-T细胞治疗的威胁时,会转而表达CD22蛋白,以逃避攻击。因此,采用CD19和CD22复合靶向CAR-T疗法,理论上可降低治疗后单个靶点的丢失导致肿瘤治疗逃逸的风险,进一步降低疾病复发。
驯鹿医疗的CT120为一款靶向CD19和CD22的全人源自体嵌合抗原受体T细胞注射液,该产品的CAR分子胞外结构域包含能特异性结合CD19和CD22的两段全人源scFv序列,通过识别表达CD19和/或CD22的肿瘤细胞以减少靶抗原丢失导致的肿瘤细胞逃逸。2021年11月,FDA授予CT120孤儿药资格认定,未来CT120将享有的优惠政策包括FDA对临床研究的支持、注册费用的减免,以及FDA批准上市后在美国的七年市场独占权。
恒润达生的抗人CD19-CD22 T细胞注射液是一种针对CD19-CD22靶点的基因工程修饰的自体CAR-T细胞制品,其作用机理是经逆转录病毒载体体外基因工程修饰,使得T细胞携带CAR元件。这一元件使得T细胞表面表达抗CD19和CD22抗体,能特异性地识别B细胞表面的CD19和CD22分子,与之结合进而激活活化信号,由此对表达CD19/CD22的细胞发挥靶向杀伤作用。2021年1月,抗人CD19-CD22 T细胞注射液获得临床试验模式许可,用于治疗B-ALL。
(2)CD19×BCMA CAR-T:BCMA是多发性骨髓瘤的有效治疗靶标,目前,靶向BCMA的ADC药物Blenrep和BCMA CAR-T Abecma已获批上市。有研究发现,尽管CD19在多发性骨髓瘤细胞表面呈现低表达,但在多发性骨髓瘤祖细胞中,CD19呈现高表达。因此,靶向CD19和BCMA有望增强对多发性骨髓瘤细胞的清除。
亘喜生物的GC012F是基于FasTCAR平台开发的靶向CD19和BCMA的自体CAR-T细胞疗法,适应症为多发性骨髓瘤,目前处于临床Ⅰ期。在2021 ASCO上,亘喜生物公布了GC012FⅠ期长期跟踪数据,GC012F在19例受试者中实现了94.7%的ORR,sCR达84.2%,mDoR未达到。安全性方面,3级及以上细胞因子释放综合征(CRS)发生率为10.5%,未观察到神经毒性。
图:GC012F结构
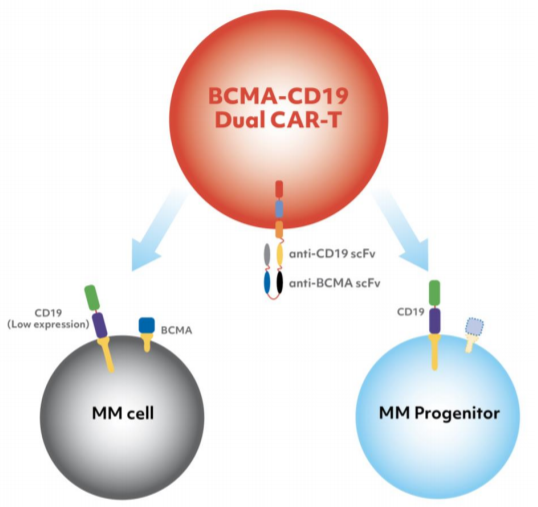
数据来源:亘喜生物
(3)CD19×CD20 CAR-T:CD19抗原丢失引起的复发是CD19靶向CAR-T疗法治疗的一个挑战。这些患者普遍预后较差,有很高的未满足医疗需求。CD20是治疗B-NHL的一个有效靶标,已在临床试验中得到验证。因此,靶向CD19及CD20的CAR-T细胞疗法有望提升对B-NHL的治疗效果。
西比曼生物的C-CAR039是一款CD19/CD20双靶点CAR-T细胞治疗产品,目前处于临床Ⅰ期。在2021 ASCO上,西比曼公布了C-CAR039用于治疗r/r B-NHL的Ⅰ期早期临床数据,28名患者实现了92.6%的客观缓解率,其中CR达85.2%。安全性方面,仅1例患者发生了3级CRS,未发生3级及以上免疫效应细胞相关神经毒性综合征(ICANS)。
(4)CD33×CLL1 CAR-T:C-型凝集素样分子1(CLL1)在正常造血干细胞(HSC)中不表达,但在急性髓性白血病(AML)细胞和白血病干细胞(LSCs)上高表达,与AML的复发关系密切。CD33在AML细胞中高表达,靶向CD33的ADC药物Mylotarg已获批上市。
成都总医院的刘芳教授在2018年EHA和2019年ASH 上分别了一款CLL1×CD33 CAR-T疗法的临床前及Ⅰ期早期研究数据。截至2019年底,刘芳主任团队完成9例患者的CLL1-CD33 CAR-T细胞治疗,其中7位实现完全缓解(CR)。安全性方面,8例患者出现了CRS,但经过积极的治疗和用药,所有患者的并发症都得到了有效的控制,没有一例患者因此而死亡。
3
小结
尽管目前全球尚无双靶点CAR-T获批上市,但一批企业对双靶点CAR-T产品寄予厚望,包括传奇生物、亘喜生物、驯鹿医疗等。从临床阶段的角度,目前绝大多数双靶点CAR-T细胞疗法仍处于临床早期。从临床数据的角度,双靶点CAR-T疗法已展现出积极的疗效和安全性数据,西比曼生物的C-CAR039获FDA授予的再生医学先进疗法(RMAT)资格和快速通道(FT)资格、驯鹿医疗的CT120获FDA孤儿药资格认定。衷心祝愿相关企业再接再厉,凭借优异的数据快速推进双靶点CAR-T产品的研发,为晚期血液肿瘤患者提供新的治疗手段。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..