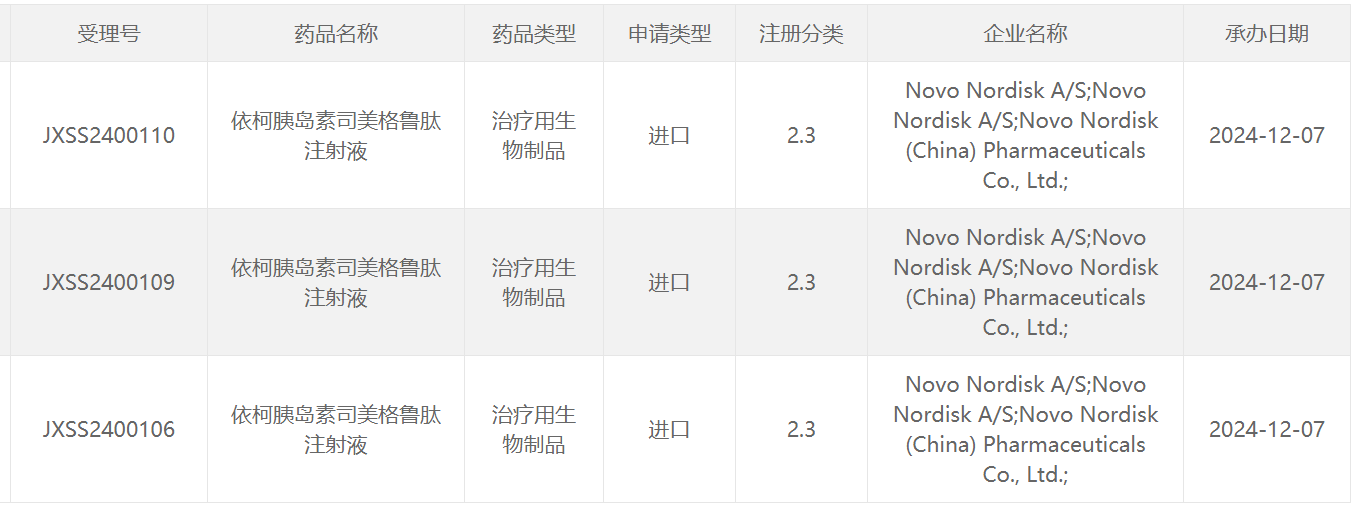
截图来源:CDE官网
今年6月,诺和诺德公布了IcoSema在关键3期试验COMBINE 1当中取得积极结果。COMBINE 1试验是一项国际性的3期试验,旨在比较每周一次的IcoSema与每周一次的依柯胰岛素(Icodec)在2型糖尿病患者中的血糖控制效果。该试验共招募1291位患者,随机分配接受IcoSema或依柯胰岛素治疗共52周,并接续为期5周的随访。
分析显示,该试验达成主要终点,与基线相较,IcoSema组患者的糖化血红蛋白(HbA1c)水平在第52周时下降了1.6个百分点,依柯胰岛素组则下降了0.9个百分点,差异具统计学意义。而在次要终点上,IcoSema组患者的体重在52周时下降了3.7公斤,依柯胰岛素组患者则增加了1.9公斤,两组差异具统计学显著性。
此外,IcoSema组患者发生严重低血糖事件的概率(每患者每年发生0.14次)亦明显低于使用依柯胰岛素治疗的患者(每患者每年发生0.63次)。IcoSema在试验中展现良好的安全性与耐受性。
IcoSema针对2型糖尿病的开发共有三项后期研究。除了COMBINE 1,诺和诺德在今年初公布了积极的COMBINE 3临床3a期试验数据,结果显示,在679名使用每日一次基础胰岛素控制不佳的2型糖尿病患者中,每周一次的IcoSema与每日注射一次的胰岛素疗法相比,在降低HbA1c上显示具非劣效性。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..