1. 口服选择性FGFR3靶向疗法TYRA-300的早期临床结果亮眼,接受剂量≥90 mg/天的FGFR3突变转移性尿路上皮癌(mUC)患者的疾病控制率(DCR)为100%。
2. 泛RAS抑制剂RMC-6236在经治胰腺导管腺癌(PDAC)患者中展现出令人鼓舞的抗肿瘤活性和安全性,携带任意RAS突变的PDAC患者在6个月的总生存率为91%。
3. 治疗转移性透明细胞肾细胞癌(ccRCC)的小分子HIF-2a抑制剂casdatifan在一项1/1b期临床试验中的DCR达81%。
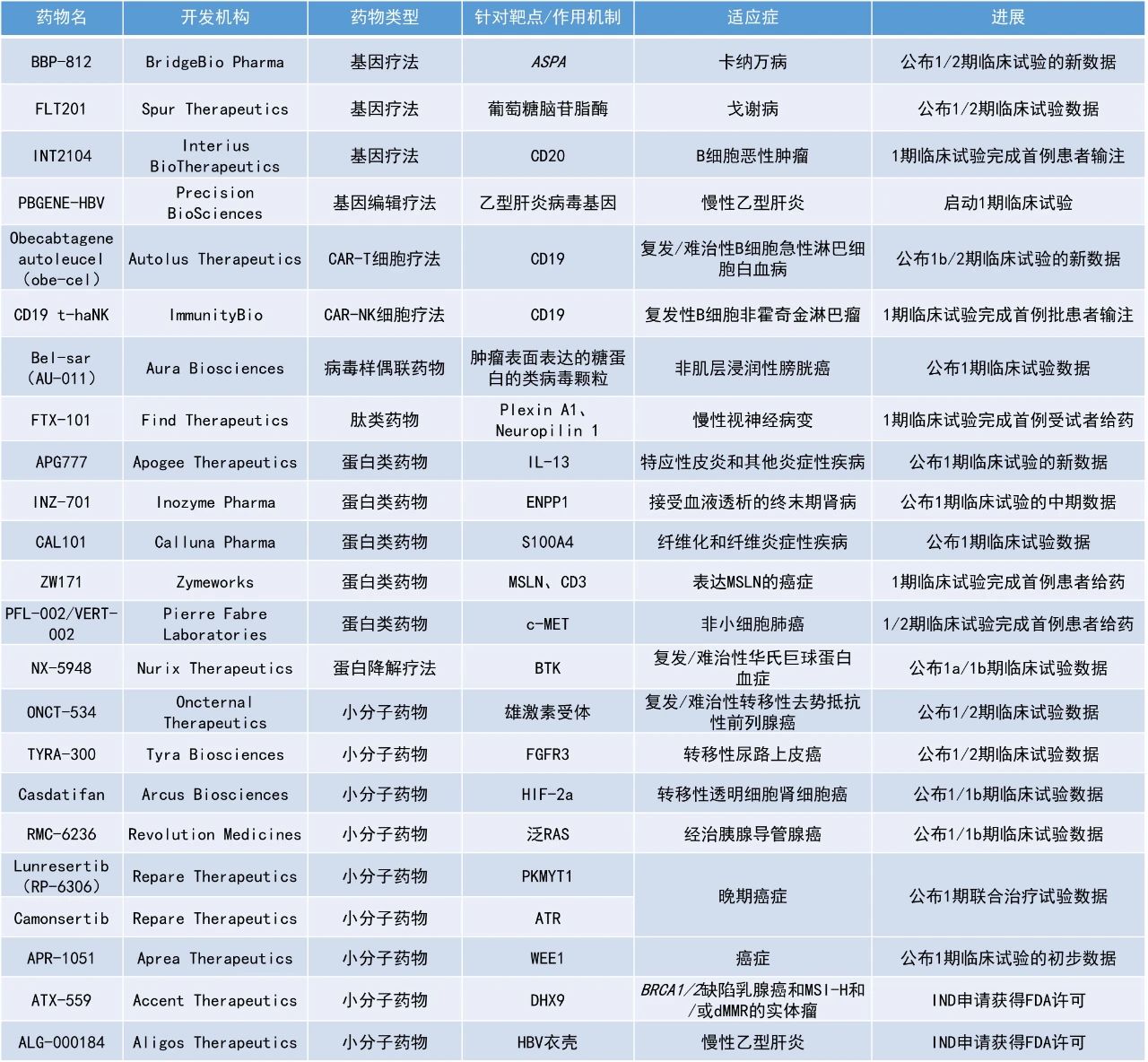
Tyra Biosciences公司公布了其潜在“first-in-class”的口服疗法TYRA-300治疗转移性尿路上皮癌(mUC)患者的1/2期研究SURF301的数据。TYRA-300是一种FGFR3选择性抑制剂,旨在避免抑制FGFR1、FGFR2和FGFR4时产生的毒性,且无论是否存在与耐药性相关的FGFR3门卫(gatekeeper)突变都能发挥作用。截至2024年8月15日的数据,接受剂量≥90 mg/天的FGFR3突变mUC患者的DCR为100%,54.5%(6/11)的患者达到部分缓解(PR),其中3例仍在治疗中,接受90 mg/天剂量的患者中有50%(5/10)达到PR。安全性方面,TYRA-300的耐受性总体良好,FGFR2和FGFR1相关毒性不常见。Revolution Medicines公司宣布,其在研泛RAS抑制剂RMC-6236在经治胰腺导管腺癌患者中展现出令人鼓舞的抗肿瘤活性和安全性。RMC-6236是一款口服、可靶向突变和野生型RAS在GTP结合(具活性,ON)状态下的选择性抑制剂。此次公布的1/1b期多中心、开放标签、剂量递增和剂量扩展研究RMC-6236-001旨在评估RMC-6236作为单药治疗携带RAS突变或野生型RAS晚期实体瘤患者的效果。结果显示,RMC-6236单药作为二线疗法可改善携带任意RAS突变PDAC患者的中位无进展生存期(PFS)与总生存期(OS)。在二线治疗中,携带KRAS G12X突变(KRAS G12X指的是KRAS蛋白第12位的甘氨酸因为基因突变,转换成其它氨基酸)的PDAC患者的中位PFS为8.5个月,中位OS为14.5个月。携带任意RAS突变的PDAC患者在二线治疗中的中位PFS为7.6个月,中位OS为14.5个月。携带KRAS G12X突变与携带任意RAS突变的PDAC患者在6个月时的总生存率分别为89%与91%。在二线治疗组中,携带KRAS G12X突变患者的客观缓解率(ORR)为29%,在三线及以上治疗组(3L+)中为22%,这些患者的DCR分别为91%和89%。目前该疗法的3期临床试验RASolute 302正在进行中。Arcus Biosciences公司公布了其在研小分子HIF-2a抑制剂casdatifan治疗转移性透明细胞肾细胞癌的1/1b期临床试验数据。HIF-2a是一种致癌转录因子,参与多个器官和肿瘤中的氧感应。由于VHL通路的基因异常,ccRCC几乎普遍与HIF-2a失调有关。通过选择性抑制HIF-2a,casdatifan可使一系列涉及肿瘤增殖和存活、耐药性和血管生成的通路失效,从而导致癌细胞死亡。截至2024年8月30日的数据,中位随访时间为11个月。在100 mg每日剂量扩展队列(n=32)中,DCR达81%,ORR为34%(2个待确认的缓解),许多患者仍在接受治疗。安全性方面,casdatifan具有可接受且可管理的安全性。Nurix Therapeutics公司公布其在研蛋白降解剂NX-5948在治疗复发/难治性华氏巨球蛋白血症(WM)患者的1a/1b期临床试验中的最新数据。NX-5948是一种口服、可穿越血脑屏障的小分子布鲁顿氏酪氨酸激酶(BTK)蛋白降解剂。Nurix此前报告称,NX-5948对一系列对现有BTK抑制剂耐药的肿瘤细胞系表现出高效的抑制活性,这对于经过大量前期治疗的B细胞恶性肿瘤患者群体尤为重要。截至2024年10月10日的数据,在9例可评估应答的患者中,7例患者(77.8%)出现客观缓解,两例患者病情稳定(22.2%)。所有7例缓解均在8周的首次评估中观察到,其中5例患者仍在接受治疗,2例患者的治疗时间超过一年。不论患者基线MYD88和CXCR4的突变状态如何,均观察到应答。Bel-sar(AU-011):公布1期临床试验数据Aura Biosciences公司宣布,其在研病毒样偶联药物(VDC)bel-sar(AU-011)在治疗非肌层浸润性膀胱癌(NMIBC)患者的1期临床试验中获得积极早期数据。Bel-sar由靶向肿瘤表面表达的糖蛋白的类病毒颗粒(VLP)与可由光激活的细胞毒性药物偶联生成。它被设计为具有双重作用机制,既能诱导肿瘤细胞坏死,又能激发强大且持久的抗肿瘤免疫反应。该试验共纳入了13名患者,主要终点是评估bel-sar单独使用(n=5)和bel-sar结合光激活(n=8)局部给药的安全性和可行性。次要终点是评估生物活性及肿瘤微环境(TME)中的免疫介导变化。13名研究参与者中,10名为低级别疾病患者,另外3名为高级别疾病患者。在接受bel-sar结合光激活治疗的患者(n=8)中,5名低级别疾病患者中有4名在组织病理学评估中显示无肿瘤细胞残留,达到了临床完全缓解(CR)。3名高级别疾病患者中有2名在膀胱镜检查中显示肿瘤明显缩小。Oncternal Therapeutics公司公布了其在研雄激素受体(AR)抑制剂ONCT-534治疗复发性或难治性转移性去势抵抗性前列腺癌(mCRPC)患者的1/2期研究的最新数据。ONCT-534在前列腺癌模型中对未发生突变的AR以及多种形式的AR突变和异常都具有活性。ONCT-534具有治疗对AR通路抑制剂耐药(包括AR扩增、AR配体结合域突变或AR配体结合域缺失型剪接变体)的mCRPC患者的潜力。截至2024年9月30日的数据,每天两次的给药方案耐受性良好,没有出现与治疗相关的3级或更高级别的毒性反应。1名患者在接受每日两次160 mg剂量ONCT-534治疗后,前列腺特异性抗原(PSA)升高,但在随后4周以每日两次300 mg剂量ONCT-534治疗后,PSA下降了50%,同时计算机断层扫描(CT)显示与基线相比,靶病灶减少了16%。循环肿瘤细胞(CTCs)的计数和生物标志物分析显示,在另外6名患者中,ONCT-534对AR调控基因的表达和AR的核转位有令人鼓舞的效果。Lunresertib+camonsertib:公布1期联合治疗试验数据Repare Therapeutics公司公布了1期临床试验MYTHIC的最新数据,该试验评估了其PKMYT1抑制剂lunresertib和口服小分子ATR抑制剂camonsertib(lunre+camo)的组合疗法。在这项分析中,Repare公司对接受2期段推荐剂量(RP2D)的患者进行了约9个月的随访。结果显示,lunre+camo在保持临床疗效的同时,成功地减轻了与抗肿瘤药物机制相关的贫血。此外,在这些患者中未观察到任何级别的血小板减少或严重的中性粒细胞减少。Accent Therapeutics公司宣布美国FDA已批准其潜在“first-in-class”的DHX9抑制剂ATX-559的IND申请,可在实体瘤患者中开展1期研究,重点关注BRCA1/2缺陷的乳腺癌和微卫星不稳定性高(MSI-H)和/或错配修复缺陷(dMMR)的实体瘤,预计首例患者将在2024年第四季度接受给药。DHX9是一种DNA/RNA螺旋酶,据报道在复制、转录、翻译、RNA剪接、RNA处理以及维持基因稳定性等方面发挥着重要作用,该酶是一个有吸引力的新肿瘤学靶点。ATX-559通过抑制DHX9可利用关键的肿瘤弱点,导致癌症特异性细胞死亡。
