8 月 12 日,CDE 官网显示,君实生物递交了特瑞普利单抗注射液的新适应症上市申请,并获得受理。特瑞普利单抗是一款抗 PD-1 单抗,此前已在国内获批 10 项适应症,并于今年 7 月递交了肝细胞癌的适应症上市申请。Insight 数据库推测,该药本次申报的新适应症可能为:一线治疗不可切除或转移性黑色素瘤。
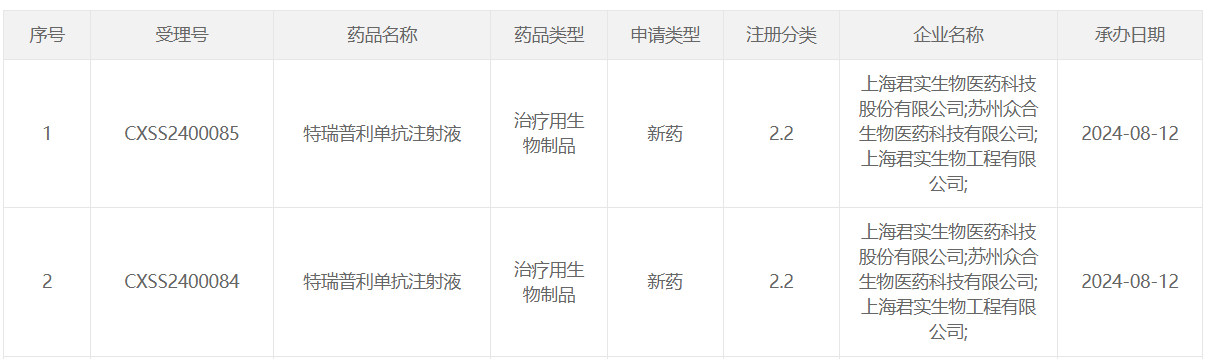
截图来自:CDE官网
特瑞普利单抗注射液是一款以 PD-1 为靶点的单抗药物。该药至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过 15 个适应症的 40 多项由君实生物发起的临床研究。研究人员正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
在国内,截至目前,特瑞普利单抗已获 NMPA 批准 10 项适应症,涉及黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非鳞状非小细胞肺癌、IIIA-IIIB 期非小细胞肺癌、肾细胞癌、广泛期小细胞肺癌、三阴性乳腺癌。在海外,该药已于 2023 年 10 月获得美国 FDA 批准治疗鼻咽癌。今年 7 月 26 日,特瑞普利单抗也获得欧洲药品管理局(EMA)人用药品委员会(CHMP)的积极意见,建议批准其用于治疗鼻咽癌和食管鳞癌的两项适应症。
根据特瑞普利单抗正在开展的临床研究进展, Insight 数据库推测其本次申报的新适应症可能为:一线治疗不可切除或转移性黑色素瘤。此前,特瑞普利单抗曾于 2018 年 12 月获批用于黑色素瘤二线治疗。
君实生物曾于 2023 年 9 月宣布,特瑞普利单抗对比达卡巴嗪一线治疗不可切除或转移性黑色素瘤的 III 期临床研究(MELATORCH 研究)的主要研究终点无进展生存期(PFS,基于独立影像评估)达到方案预设的优效边界。
MELATORCH 研究(NCT03430297)是一项多中心、随机、开放、阳性药对照的 III 期临床研究,旨在比较特瑞普利单抗与达卡巴嗪一线治疗不可切除或转移性黑色素瘤患者的有效性和安全性。筛选合格的受试者以 1:1 随机分配接受特瑞普利单抗或达卡巴嗪治疗,直至疾病进展或不可耐受毒性等。
该试验的主要研究终点是基于独立影像评估的 PFS,次要研究终点包括研究者评估的 PFS、独立评审委员会(IRC)或研究者评估的客观缓解率(ORR)、缓解持续时间(DOR)和疾病控制率(DCR)、总生存期(OS)以及安全性等。北京大学肿瘤医院郭军教授为该研究的牵头主要研究者,11 家国内中心参研,共随机入组 256 例受试者。
研究结果表明,相较于达卡巴嗪,特瑞普利单抗一线治疗不可切除或转移性黑色素瘤可显著延长患者的 PFS。特瑞普利单抗安全性数据与既往研究相似,未发现新的安全性信号。该研究的详细数据将在后续的国际学术大会上公布。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..