收集周期:1.22-1.26,国内部分为首次申请临床、首次申请上市、首次批准上市的创新药
国内创新药IND汇总

1、恒瑞医药:HRS2398缓释片
作用机制:ATR抑制剂
适应症:肿瘤
1月23日,恒瑞医药的HRS2398缓释片的临床申请获CDE受理。HRS2398以加剧DNA双链损伤,抑制细胞增殖,发挥抗肿瘤作用。ATR即“共济失调毛细血管扩张突变基因Rad3相关激酶”,属于磷脂酰肌醇3-激酶(PIKK)家族中的丝氨酸-苏氨酸激酶,ATR激酶激活后可通过多种信号调控细胞生物过程, 包括细胞周期阻滞、抑制复制起点、促进脱氧核苷酸合成、启动复制叉以及修复DNA双链断裂。研究发现,ATM和ATR 激酶在癌细胞中被激活或上调,同时ATR是ATM突变的合成致死靶点,ATM缺失的肿瘤细胞对于ATR抑制剂更加敏感。该药物普通片于2021年8月获得CDE批准开展临床试验,用于晚期恶性肿瘤。
2、Vera:阿塞西普皮下注射液
作用机制:TACI-Fc融合蛋白
适应症:IgA肾病
1月23日,Vera的阿塞西普皮下注射液的临床申请获CDE受理。阿塞西普(Atacicept)是一种含有可溶性跨膜激活剂和钙调亲环素配体相互作用因子(TACI)受体的重组融合蛋白,可以与细胞因子B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)结合。该药物能够靶向B细胞和浆细胞以减少自身抗体,具有“best-in-class”的药物潜力。
2023年6月,Vera宣布atacicept治疗IgA肾病(IgAN)的2b期临床试验ORIGIN中达到主要和关键性次要终点,即接受治疗36周时,atacicept(150 mg剂量)组的蛋白尿指标与安慰剂组相比降低35%(p=0.012)。在排除未遵守试验方案的患者后,atacicept组的蛋白尿指标与安慰剂组相比降低43%(p=0.003);此外,在ITT分析中,接受安慰剂治疗的患者eGFR会下降,而接受atacicept治疗的患者在36周内的eGFR保持稳定。
3、凡恩世:PT217
作用机制:靶向CD47/DLL3双抗
适应症:肿瘤
1月24日,凡恩世的PT217的临床申请获CDE受理。PT217是一款靶向CD47/DLL3的双抗,可通过巨噬细胞的ADCP活性和NK细胞的ADCC活性直接杀伤肿瘤细胞,并通过同时靶向肿瘤细胞表面过度表达的DLL3和CD47扩大肿瘤杀伤范围。此外,PT217有望通过引导肿瘤细胞进入吞噬性抗原呈递细胞(APCs)来诱导肿瘤新抗原的呈递,并通过识别肿瘤新抗原,间接激活T细胞对低表达或不表达DLL3的肿瘤细胞的杀伤,从而刺激获得性免疫系统。PT217的抗CD47单臂具有高度差异化,并且已经在临床前模型中显示,其在与人红细胞最小程度结合的同时,又保持很强的与肿瘤细胞上CD47的结合活性。
PT217已于2022年获得FDA批准在美国开展一项多中心临床I期试验,并于2022年获得了FDA授予的孤儿药资格认定,用于治疗小细胞肺癌。
4、天泽云泰生物:VGN-R09b注射液
作用机制:——
适应症:帕金森病、芳香族L-氨基酸脱羧酶缺乏症
1月25日,天泽云泰生物的VGN-R09b注射液的临床申请获CDE受理,适应症为原发性帕金森病(PD)和芳香族L-氨基酸脱羧酶缺乏症(AADCD),是国内首个递交临床试验申请并获得受理的基因治疗品种。VGN-R09b使用重组AAV作为基因治疗载体,以递送有功能的AADC为基础恢复多巴胺的生成,从而发挥相应的潜在的治疗作用。通过局部纹状体注射的方式,使药物能够直接作用于发病部位,减少全身的给药剂量,从而减少相应的免疫反应等不良反应。理论上,基因治疗只需要注射一次就能起到相应的长期疗效。
5、石药/津曼特生物:JMT106注射液
作用机制:靶向GPC3/IFN融合蛋白
适应症:肿瘤
1月25日,石药/津曼特生物的JMT106注射液的临床申请获CDE受理。JMT106以GPC3和干扰素受体为靶点的双特异性融合蛋白药物,通过GPC3抗体的靶向性杀伤肿瘤细胞,激活由干扰素受体介导的肿瘤微环境免疫调控作用。GPC3在肝细胞癌、肺鳞癌和卵巢癌等多种实体瘤中特异性高表达。临床前研究显示,JMT106适应症广泛,在肝癌、肺癌和卵巢癌等恶性肿瘤模型中具有显著的抗肿瘤作用,并具有良好的安全性。
6、英百瑞生物:IBR822细胞注射液
作用机制:靶向Trop2 CAR-raNK
适应症:实体瘤
1月26日,英百瑞生物的IBR822细胞注射液的临床申请获CDE受理。BR822细胞注射液是抗体-NK细胞偶联药物(Trop2 CAR-raNK),由靶向人源Trop2抗原的全长单克隆抗体与体外扩增得到的同种异体健康供者外周血来源的NK细胞通过连接子化学偶联而成。具有更强的靶向性,能通过抗Trop2单克隆抗体特定靶向Trop2抗原的肿瘤细胞,并通过NK细胞的直接裂解靶细胞、分泌细胞因子、诱导凋亡、ADCC和免疫检查点途径等5大作用机制发挥肿瘤杀伤作用,在最大程度地发挥靶细胞杀伤作用的同时降低脱靶毒性。另外,该候选产品为非基因修饰的特定靶向肿瘤抗原的NK细胞,可避免因病毒/非病毒载体整合导致插入突变致癌的危险,具有更高的安全性。
国内创新药NDA汇总
1、强生:甲磺酸兰泽替尼片
作用机制:EGFR T790M抑制剂
适应症:非小细胞肺癌
1月26日,强生的甲磺酸兰泽替尼片的新药上市申请(NDA)获CDE受理。兰泽替尼(lazertinib)是第三代EGFR酪氨酸激酶抑制剂(EGFR-TK),该药物最早由Yuhan(柳韩洋行)研发,韩国之外的权益已转让给美国强生旗下的杨森制药。Lazertinib在具有激活EGFR突变、T790M突变和中枢神经系统(CNS)疾病的非小细胞肺癌患者中具有强活性。2021年1月18日,韩国食品药品管理局(MFDS)批准Lazertinib用于既往接受过EGFR-TKI治疗的EGFR T790M突变阳性局部晚期或转移性非小细胞肺癌患者的治疗。
在一项全球性双盲试验,随机分配有EGFR-TKI一线治疗资格的初治、EGFR突变的局部晚期或转移性非小细胞肺癌成年患者接受拉泽替尼(n=196)或吉非替尼(n=197)治疗。主要终点是研究者根据RECIST 1.1标准评估的无进展生存期(PFS)。次要终点包括总生存期(OS)、客观缓解率(ORR)、反应持续时间(DOR)、疾病控制率(DCR)和安全性。数据截至2022年7月29日,拉泽替尼治疗组 VS 吉非替尼治疗组的中位无进展生存期(PFS)为20.6个月 VS 9.7个月(HR为0.45;95%,置信区间:0.34-0.58;P< .001)。总体客观缓解率(ORR)为76.0% VS 76.1%。其中,大部分是部分缓解(PR),分别有2例和1例患者经历了完全缓解(CR);此外,拉泽替尼治疗组 VS 吉非替尼治疗组的中位反应持续时间(DOR)为19.4个月 VS 8.3个月;疾病控制率(DCR)均为93.9%。在数据截止时,总生存期(OS)数据尚不成熟;然而,估计18个月的OS率为80.3% VS 72.4%,24个月的OS率为66.4% VS 58.4%。该试验的安全性数据显示,在拉泽替尼治疗组中,见的任何级别治疗相关不良反应包括:感觉异常(39%)、皮疹(36%)、瘙痒(27%)、甲沟炎(18%)和皮肤干燥(15%);在吉非替尼治疗组中,常见的任何级别治疗相关不良反应包括:腹泻(39%)、皮疹(37%)、丙氨酸转氨酶升高(30%)和天冬氨酸转氨酶升高(26%)。
国内创新药获批上市
1、辉瑞:瑞美吉泮口崩片
作用机制:CGRP受体拮抗剂
适应症:急性偏头痛
1月26日,辉瑞的瑞美吉泮口崩片(商品名:乐泰可)获得中国国家药品监督管理局(“NMPA”)批准,用于成年人有或无先兆偏头痛的急性治疗。乐泰可在美国商品名为Nurtec® ODT,是全球首个且唯一采用专利口崩片技术的降钙素基因相关肽(CGRP)受体拮抗剂,也是目前在全球唯一在美国FDA和欧盟EMA均获批的,同时具备急性及预防性治疗偏头痛适应症的药物。瑞美吉泮(rimegepant)最早由Biohaven公司研发,2022年5月,辉瑞以116 亿美元全资收购Biohaven,以丰富其在神经学疾病领域的管线布局。
2022 年 2 月,Biohaven和辉瑞共同宣布,rimegepant在中国和韩国等亚太地区用于急性偏头痛成人患者的 3 期临床试验取得积极的顶线结果。该研究在单剂量口服rimegepant 2小时后达到了疼痛(p<0.0001)和偏头痛相关症状(MBS)(包括恶心、畏声或畏光)缓解(p<0.0001)的共同主要终点。在这项研究中,患者在2小时内能恢复正常生活,部分疗效持续可达48小时;安全性上,rimegepant表现出良好的安全性和耐受性,与之前在美国的临床试验结果一致。
2、诺和诺德:司美格鲁肽片
作用机制:GLP-1受体激动剂
适应症:2型糖尿病
1月26日,诺和诺德的司美格鲁肽片获NMPA批准上市。司美格鲁肽(semaglutide)是一款GLP-1降糖减重药物,该药物通过与GLP-1受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的代谢。同时,它还能够能起到延缓胃排空和抑制食欲的效果。目前获批上市的有三种形式,包括皮下注射用于降糖的Ozempic、口服给药用于降糖的Rybelsus以及皮下注射用于减重的Wegovy。司美格鲁肽片是司美格鲁肽和吸收促进剂(SNAC)的复合制剂,独特之处在于SNAC能够促进司美格鲁肽在胃部被吸收,且提高环境的pH值,提高司美格鲁肽的溶解度,防止其被胃中的肽酶降解。
根据2023年3月公布的最新试验数据,对比了更高剂量的口服司美格鲁肽(25mg、50mg)与此前已获批的14mg剂量在治疗2型糖尿病的效果。该临床试验达到主要终点,在治疗第52周时,25mg和50mg剂量的口服司美格鲁肽对糖化血红蛋白(HbA1c)的降低效果显著优于14mg剂量,减重效果也同样显著优于14mg剂量。除此以外,患者平均基线HbA1c为9.0%,14mg、25mg和50mg剂量组患者HbA1c分别降低了1.5%、1.9%和2.2%;患者平均基线体重为96.4kg,14mg、25mg和50mg剂量组患者体重分别降低了4.5kg、7.0kg和9.2kg。口服司美格鲁肽的各个剂量似乎都具有良好的安全性和耐受性。
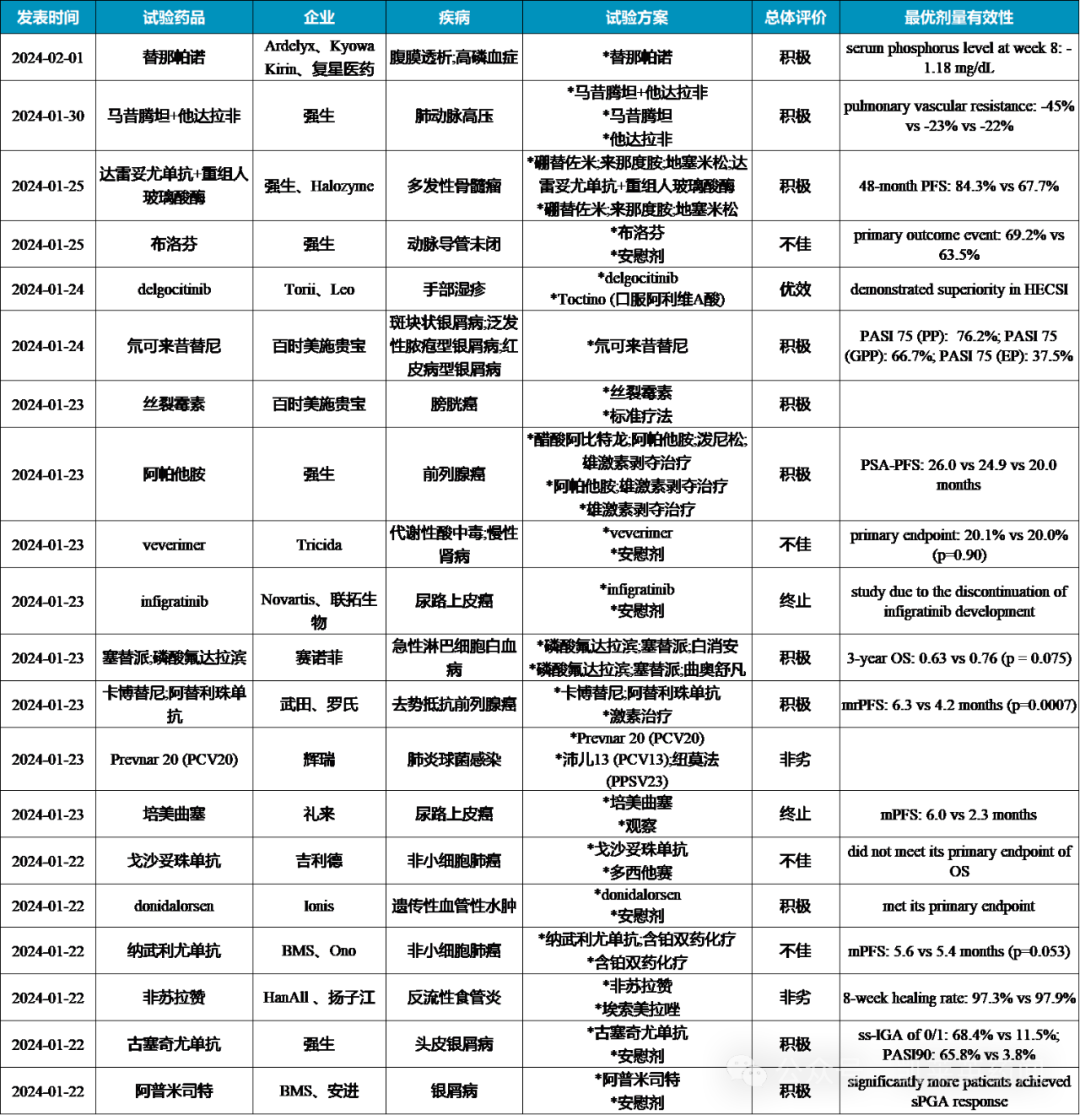
全球III期临床汇总
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..