8月19日,中国国家药监局药品审评中心(CDE)官网公示,强生(Johnson & Johnson)旗下杨森(Janssen)递交的特立妥单抗注射液上市申请已获受理。公开资料显示,特立妥单抗(teclistamab)是一款靶向BCMA和CD3的“first-in-class”双特异性抗体疗法,已在欧盟和美国获批上市。此前,该药已在中国被纳入突破性治疗品种,用于治疗复发或难治性多发性骨髓瘤成人患者。
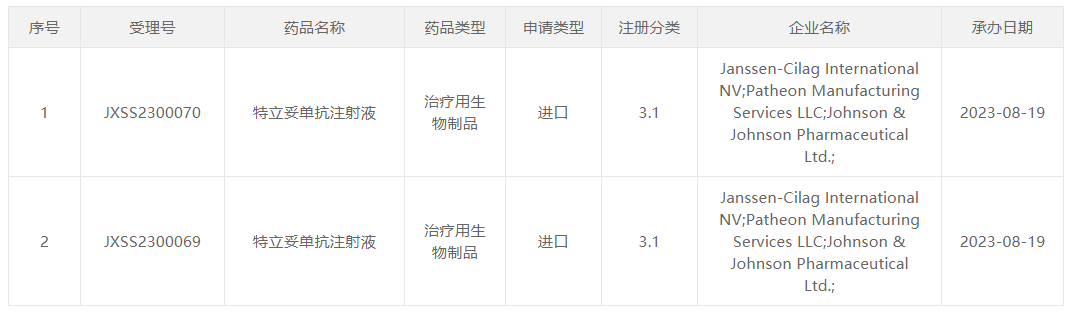
截图来源:CDE官网
多发性骨髓瘤是血液系统的第二常见恶性肿瘤。目前它仍然是一种无法治愈的血液癌症,几乎所有患者会出现复发并且需要接受后续治疗。随着疾病的进展,每次复发的侵袭性增强,而新疗法获得的缓解期逐渐缩短。
公开资料显示,teclistamab是一款即用型、皮下注射的靶向B细胞成熟抗原(BCMA)和T淋巴细胞表面CD3受体的双特异性抗体。它可以将CD3阳性T细胞募集到表达BCMA的骨髓瘤细胞附近,并且激活T细胞对肿瘤细胞进行攻击。此前,该产品已获得美国FDA授予治疗多发性骨髓瘤的突破性疗法认定,并获欧洲药品管理局(EMA)颁发的优先药物资格(PRIME)。
2022年8月,teclistamab获得欧盟批准上市,用于已经接受至少三种前期疗法的复发/难治性多发性骨髓瘤成人患者。同年10月,该药获得美国FDA批准上市,用于治疗复发/难治性多发性骨髓瘤成人患者。根据杨森公司早前新闻稿介绍,它是首款获批治疗多发性骨髓瘤的双特异性疗法,也是首款获批靶向BCMA的双特异性抗体,为难治性患者提供了一种“现货型”治疗手段。

Teclistamab在欧盟的批准得到开放标签1/2期临床试验MajesTEC-1的积极结果的支持。试验结果显示,在165名接受每周皮下注射teclistamab的患者中,总缓解率达到63%,值得一提的是,58.8%的患者获得非常好的部分缓解(VGPR)以上的应答,39.4%的患者获得完全缓解(CR)以上的应答。该结果已经在《新英格兰医学杂志》(NEJM)上发表。试验结果显示患者获得深度和持久的缓解,中位缓解持续时间达到18.4个月,中位无进展生存期为11.3个月,中位总生存期为18.3个月。
FDA对该药的加速批准得到关键性2期临床试验MajesTEC-1的积极结果的支持。参与试验的患者(N=110)接受过的前期治疗中位数目为5。试验结果显示,这一患者群体的总缓解率达到61.8%。值得一提的是,28.2%的患者获得完全缓解以上的应答。在中位随访时间为7.4个月时,估计的6个月缓解持续率为90.6%,9个月缓解持续率为66.5%。
在中国,teclistamab于2021年6月获批开展治疗多发性骨髓瘤的临床试验。目前,该产品正在开展一项针对复发或难治性多发性骨髓瘤受试者的1/2期、首次用于人体、开放性、剂量递增研究,以及一项治疗复发或难治性多发性骨髓瘤受试者的3期国际多中心随机研究。
2022年8月,teclistamab被CDE纳入突破性治疗品种,针对适应症为:复发或难治性多发性骨髓瘤成人患者,这些患者既往至少接受过3线治疗,包括一种蛋白酶体抑制剂(PI)、一种免疫调节剂(IMiD)和一种抗CD38单克隆抗体。本次,该药的上市申请获得CDE受理意味着其距造福病患又近了一步。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Aug 19, 2022, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2] Janssen Marks First Approval Worldwide for TECVAYLI®▼(teclistamab) with EC Authorisation of First-in-Class Bispecific Antibody for the Treatment of Patients with Multiple Myeloma. Retrieved August 24, 2022, from https://www.businesswire.com/news/home/20220822005274/en
[3] U.S. FDA Approves TECVAYLI™ (teclistamab-cqyv), the First Bispecific T-cell Engager Antibody for the Treatment of Patients with Relapsed or Refractory Multiple Myeloma. Retrieved October 25, 2022, from https://www.prnewswire.com/news-releases/us-fda-approves-tecvayli-teclistamab-cqyv-the-first-bispecific-t-cell-engager-antibody-for-the-treatment-of-patients-with-relapsed-or-refractory-multiple-myeloma-301659083.html
[4] Moreau et al., (2022). Teclistamab in Relapsed or Refractory Multiple Myeloma. NEJM, DOI: 10.1056/NEJMoa2203478
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..