对于创新药而言,上市仅是“万里长征第一步”,能否成功还取决于商业化运作能力。
近期,一款AD新药Leqembi获得美国FDA完全批准,用于治疗患有轻度认知障碍或轻度阿尔兹海默病(AD)的患者,引发行业关注。Leqembi是自2003年来首个获得FDA完全批准的AD新药。

Leqembi是卫材和BioArctic合作研发的成果,由卫材和渤健共同负责该产品的开发和商业化,且卫材拥有最终决策权。但在完全批准后,渤健的股价却没有意料中那样飙升,在7月7日批准当天,其股价截至当日收盘反而下跌了3.48%。截止7月11日,渤健收盘价为279.84元,跌1.74%。
市场反响不及预期,体现了业内对该药物商业化前景的担忧。对于AD药物而言,获得监管机构批准只是第一步,而后面临的商业化才是真正的挑战。
此前,同为卫材和渤健研发的近20年来首个获批的、基于Aβ假说的Aduhelm,遭遇了限制使用、销售惨淡、企业裁员、高管离任等一系列挫折。
本次Leqembi上市,围绕产品的疗效,以及安全性和支付价等情况同样备受市场关注和热议。完全批准之后,Leqembi未来能否为渤健在阿尔茨海默病领域扳回一城?
01
年费用2.6万美元
商业化前景几何?
AD是一种严重的神经退行性疾病,患者起初主要出现记忆力衰退、学习能力减弱的症状,随着病情发展,会出现情绪调节障碍以及运动能力丧失,并最终导致死亡。随着老龄化社会加剧,AD患病率在不断上升,预计到2050年,AD患者人数将增加至1.5亿以上。
AD的发病机制复杂,至今仍未完全破译,长期被认为是医药研发的“黑洞”领域,不过β淀粉样蛋白(Aβ)假说和Tau蛋白假说正在成为药企研发药物的突破口。
据了解,Leqembi为抗β淀粉样蛋白(Aβ)抗体,能与可溶性和难溶性Aβ聚合体结合,并且促进它们的清除,具有改变疾病病理,缓解疾病进展的能力,以达到治疗阿尔茨海默病的目的。
去年5月,卫材/渤健就向FDA提交了Lecanemab的BLA,两个月后,获得优先审评资格。2022年11月,渤健公布了Lecanemab的大规模III期临床研究结果,试验共纳入1795例早期AD患者,按1:1的比例随机接受安慰剂或Lecanemab治疗,每隔一周静脉滴注1次,持续18个月。
III 期试验数据表明,与安慰剂组相比,Leqembi治疗在 18 个月时显示出统计学差异。其在临床上显示出更低的认知和功能量表结果数据,受试患者认知和功能下降减少了 27%(CDR-SB评分越高意味着患者临床功能越低),并在18个月里将淀粉样蛋白沉积水平降低约70%。
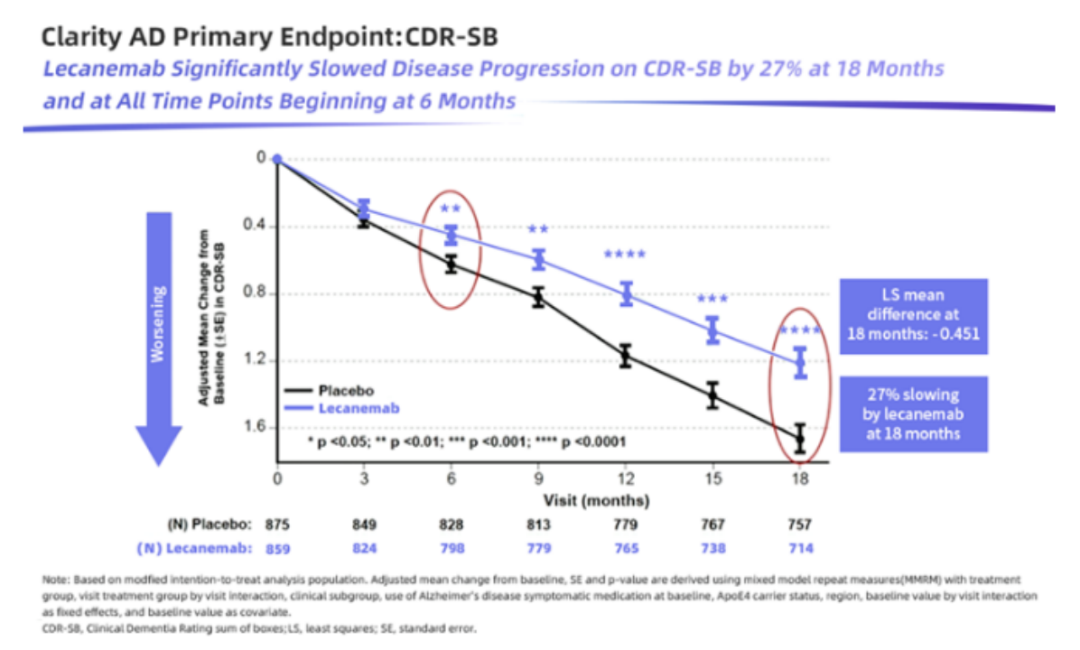
对此,业内质疑,Leqembi仍然是基于Aβ假说,但Aβ假说本身依然存在很多未知,以及多重其他假说致病机理始终无法明确。因此,有观点认为,Aβ靶向抗体作为AD 新药开发的重要方向,存在很大的不确定性。此外,Leqembi带来的27%改善,对阿尔茨海默病患者的意义有多大,依然有待在真实世界的临床治疗中进行长期观察。
除了有效性,药物安全性和经济性也是药物价值的重要考评指标之一。
据悉,Leqembi是需要静脉给药,该药物每两周静脉注射一次,根据患者体重剂量为10mg/kg,按照患者体重80kg计算,每人年用量20g,年费用2.65万美元。同时,卫材表示,到2030年,lecanemab在全球的年销售额将达到70亿美元。
阿尔兹海默症协会的数据显示,2023年美国大约有670万名阿尔兹海默症患者,其中适用于Leqembi适应症早期阿尔兹海默症的预计有150万人。在业内看来,虽然这样的数据看上去能创造良好的销售额,但对于阿尔兹海默症患者及其家庭,就算纳入了医保,也不能确保患者有能力支付。
根据研究医疗保健问题的非营利组织KFF的估计,即使纳入了各种不同的医保,这些患者每年的账单可能超过5000美元。而KFF医疗保险专家表示,即使有医疗保险,中等收入的人群也可能负担不起Leqembi的自付费用。
Leqembi虽然到了完全批准,也被纳入了美国医保,患者群体也在不断扩大,但是患者和其家属是否决定乐意采用或支付得起这一治疗方案,恐怕还需要未来的验证,这可能对渤健提出更严苛的商业化挑战。
02
竞争对手悄然而至
市场机会如何把握?
根据 World Alzheimer Report数据统计显示,2015年全球阿尔茨海默症患者人数为4680万,预计2030年增长至7470万,到2050年时,这个数字将会达到1.3亿。从地域分布来看,病人数量增长最快的主要是中低收入国家,2050年时中低收入国家的患者比例将进一步扩大至68%。
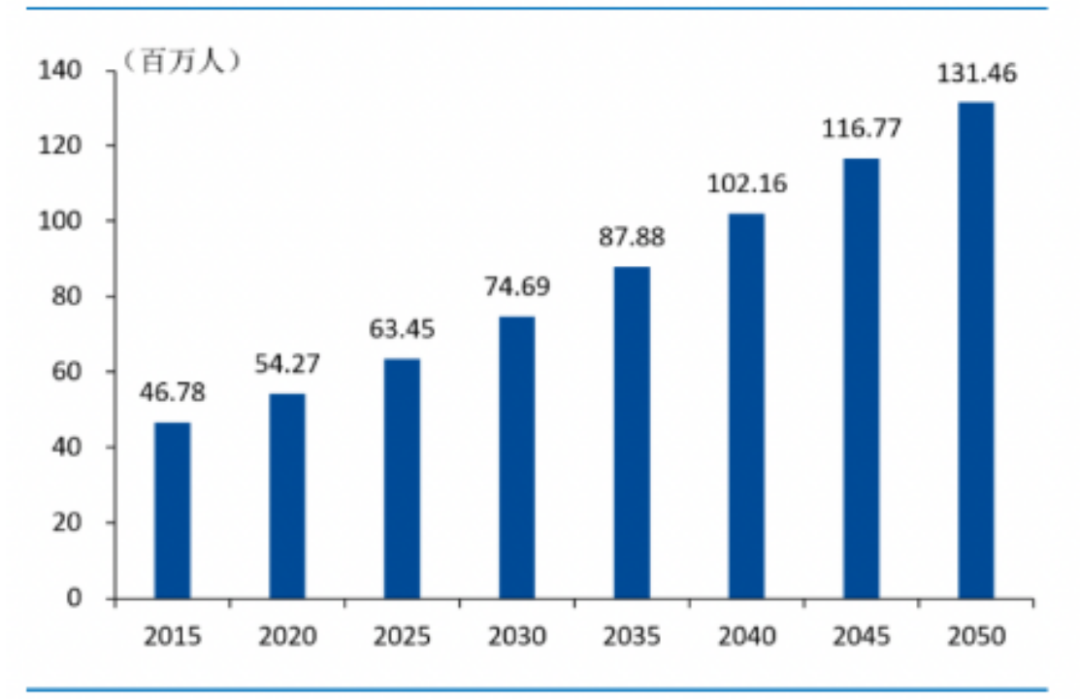
2015-2050年预计全球阿尔茨海默症患者人数
作为老年性疾病,老年人口的增加也直接推动了阿尔茨海默症治疗药物的市场需求。目前全球阿尔茨海默症的治疗市场规模在45亿美元左右,最近 5 年的复合年增长率仅为 1.91%。
目前市场上的阿尔茨海默症治疗药物还非常少,且治疗效果有限,这是制约市场发展的一个重要因素。过去20多年,除了Leqembi和Aduhelm之外,FDA仅批准了5款AD治疗药物,包括:他克林(Tacrine)、多奈哌齐(Donepezil)、卡巴拉汀(Revastigmine)、加兰他敏(Galantamine)和美金刚(Menantine)。

其中前四种为乙酰胆碱酶(AchE)抑制剂、美金刚为N-甲基-D-天冬氨酸(N-Methyl-D-aspartic acid, NMDA)受体拮抗剂。AchE抑制剂与NMDA受体拮抗剂药物均为对症治疗,主要是改善认知和记忆障碍,并不能阻止或者延缓病情的进展,且两类药物都存在严重的副作用。
2021年6月7日,美国FDA批准了渤健/卫材公司的单抗药物Aduhelm上市,用于治疗AD。不过,但是,Aduhelm上获得FDA批准后,立即引发了巨大争议,临床试验显示,这款单抗药物能够清除大脑中的β-淀粉样蛋白(Aβ),但没有足够证据表明其能够减缓或阻止阿尔茨海默病的疾病进展,三位FDA评审专家愤而辞职,以示抗议。
且该药物价格昂贵,高达5.6万美元/年。由于缺乏有效性证据,且存在副作用风险,该药物虽然获得美国FDA批准上市,但美国各大保险公司纷纷拒绝支付该药物的治疗费用。在当年12月份,渤健便将Aduhelm在美国的批发价格削减一半。
因此,渤健两款AD新药Leqembi和Aduhelm上市,并未能为其带来新的增长收益。2023年一季度渤健总营收24.63亿美元,同比下降2.7%。值得注意的是,其核心业务多发性硬化症(MS)药物系列销售额大幅下滑,AD板块更是深陷泥潭,损0.18亿美元。
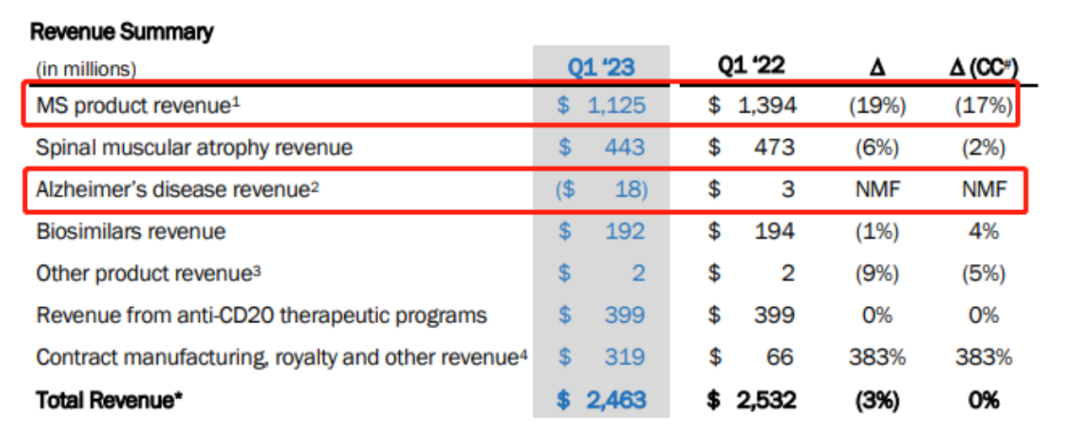
尽管Leqembi获得FDA全面批准,并获得医疗保险优惠覆盖,但大家对Aduhelm受挫的上市经历仍心有余悸,且学术界对“淀粉样蛋白假说”的质疑声依旧不断;另一方面Leqembi此后可能还要面临礼来的Donanemab的竞争。
继2022年9月 Leqembi 公布三期临床试验结果后,2023年5月礼来研发的AD新药Donanemab也发布了三期结果,值得关注的是Donanemab在18个月时表现出29%的认知衰退减缓效果。
礼来表示,Donanemab达到了试验的所有目标,计划在6月底前申请FDA的审批,FDA会在今年底或2024年初做出决定。因而,Donanemab有望成为Aduhelm、 Leqembi 之后第三款在美国获批的Aβ单抗药物。
总的来说,除了卫材和渤健,罗氏、礼来等企业仍然在围绕阿尔茨海默病药物进行着临床探索,对于渤健/卫材而言,新药获得美国FDA批准,毋庸置疑是一个重要的里程碑,在可以预见的未来,产品也将面临更多的市场考验。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..