自噬(autophagy)和外泌体(exosome)两者都是近年来国自然基金中标数较多的科研热点——在2022年医学部科研热点中,自噬和外泌体分别凭借540项和431项中标项目,位列第三和第五名。
在真核生物中,细胞可以通过自噬和外泌体的分泌两种方式来对外界刺激做出应答,从而维持细胞内稳态。因此,探究自噬和外泌体的机制以及两者之间的关系,无疑是非常具有价值和意义的事情。
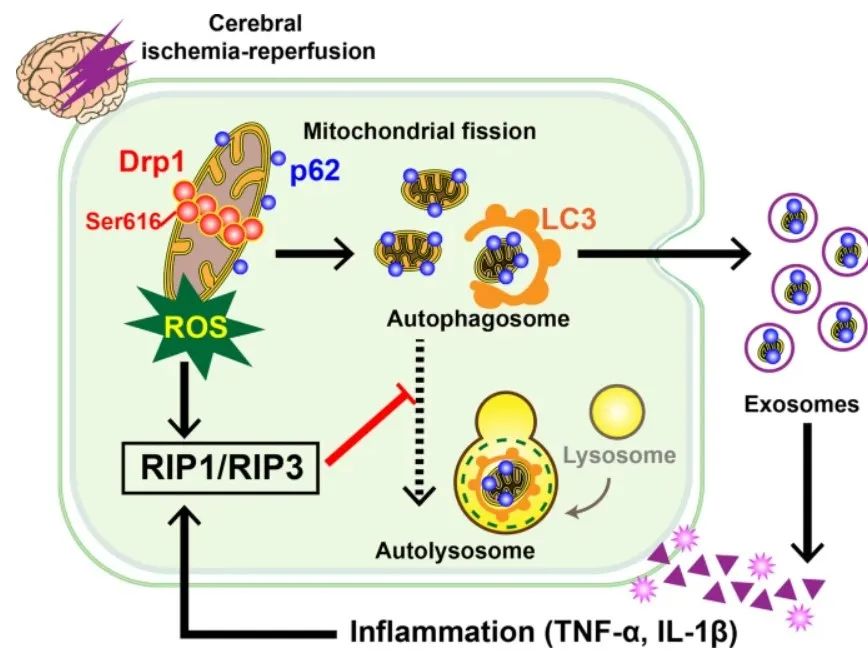
今天,小编将带大家解读一篇发表在Military Medical Research(34.915分)的研究,该研究题为“Activated Drp1 regulates p62-mediated autophagic flux and aggravates inflammation in cerebral ischemia-reperfusion via the ROS-RIP1/RIP3-exosome axis”。这项研究很好地将自噬和外泌体结合在一起,实现了1+1>2的突破!
具体来说,本项研究通过一系列的体内外实验,证实了脑缺血再灌注损伤(CIRI)激活 Drp1 并加速p62介导的自噬体形成,同时通过RIP1/RIP3通路激活抑制自噬体向自溶酶体的转变。

一、研究背景
脑缺血再灌注损伤(CIRI)是指当缺血脑组织的血液供应恢复时可能发生的继发性脑损伤。然而,这种损伤的潜在机制仍有待研究。
作为调节线粒体裂变的关键蛋白,Drp1通常自由分布于细胞质内;然而,它在缺氧损伤后的激活导致其从细胞质转移到线粒体表面,在那里它通过GTP酶切割线粒体磷脂双分子层,引发线粒体分裂和断裂。事实上,线粒体质量失衡存在两个关键过程,但Drp1介导的线粒体裂变和p62介导的自噬通量是否因CIRI损伤而改变?这两个过程之间是否存在内部相关性?以及Drp1和p62如何参与调节CIRI的恶性循环的?以上问题的答案仍不清楚。
在这项研究中,大脑中动脉闭塞 (MCAO) 模型小鼠和SH-SY5Y细胞中氧-葡萄糖剥夺/复氧 (OGD/R) 的体外模型用于阐明Drp1和p62介导的线粒体质量的发生CIRI 后的不平衡。然后,通过线粒体质量检测和自噬通量测定,探讨Drp1激活对p62介导的自噬体形成和CIRI后降解的调控机制。最终,阐述了线粒体质量失衡在CIRI潜在恶性循环中的关键作用。这表明CIRI的触发可能是由激活的Drp1介导的线粒体质量失衡,而导致CIRI恶性循环的关键因素可能是大量的ROS积累。与CIRI相关的恶化被认为是由于RIP1/RIP3通路中发生的正反馈自噬流受阻以及含有p62的大量外泌体释放所致。本研究从线粒体损伤的角度系统探讨了CIRI恶性循环的病理生理过程,为CIRI的防治提供了实验依据和干预靶点。
二、研究思路

三、研究方法
1、模型准备
1)MCAO
将200只雄性C57小鼠(8周龄,21-25g)禁食过夜,但允许自由饮水(正常组:50 只小鼠,MCAO 组:50 只小鼠,MCAO + Mdivi-1 组:50 只小鼠,MCAO + NAC 组:50 只小鼠)。至于MCAO模型的程序,麻醉是在 70% 氧化亚氮与氧气平衡的混合物中用 3.5% 氟烷诱导的。在手术显微镜下,通过颈部正中切口暴露左侧颈总动脉,并从其分叉处到颅底,仔细地从周围的神经和筋膜中分离出来。然后分离、解剖和凝固颈外动脉的枕动脉分支。分离颈内动脉并小心地将其与邻近的迷走神经分开,并结扎翼腭动脉。接下来,一个带有0的螺纹塞。20mm直径硅胶头经颈外动脉近端插入颈内动脉,然后进入Willis环,有效阻断大脑中动脉。左侧大脑中动脉阻断1 h后,拔出螺纹塞,使血液回流至颈内动脉24h。
2)细胞 OGD/R 处理
SH-SY5Y 细胞在不含 FBS 的DMEM中培养,转移到缺氧培养室并在缺氧条件下孵育 4 小时。然后将培养基更换为补充有 10% FBS的 DMEM-F12,并将细胞在 37℃ 下孵育 12 小时。
2、脑血流散斑断层扫描
3、线粒体形态
4、线粒体 DNA (mtDNA) 拷贝数检测
进行mtDNA拷贝数检测以确定线粒体的数量。
5、细胞内 ROS 和线粒体 ROS 的测量
细胞内 ROS 的测量,包括 SH-SY5Y 细胞中的 DCFH-DA 检测和 DHE,根据试剂盒说明进行。
6、自噬通量测定
7、侵袭性检测
8、GEO数据分析
9、免疫共沉淀
10、HE、免疫组化、免疫荧光染色
11、透射电镜成像
12、Western blot
四、研究结果
首先,研究者发现,激活的Drp1导致CIRI后线粒体过度分裂和ROS积累。
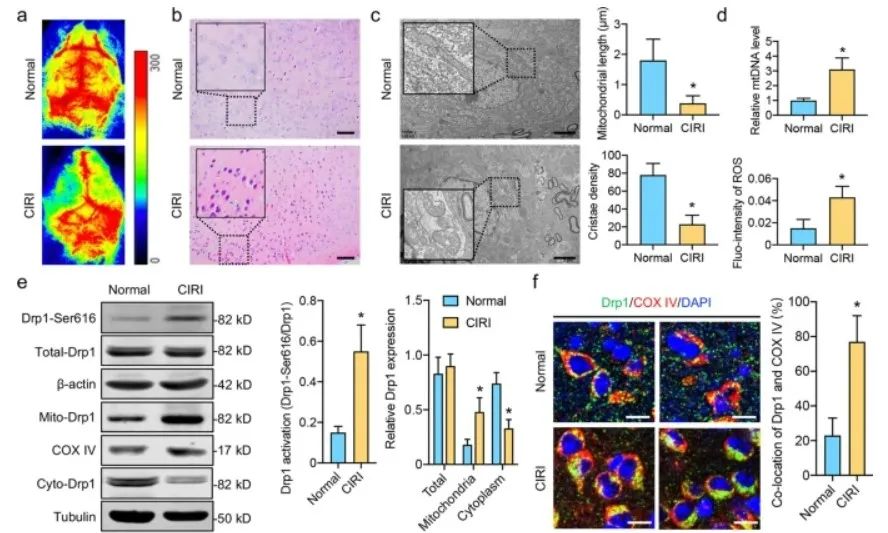
免疫荧光图像显示,在CIRI后,p62和COX IV标记的线粒体在梗死区域的共定位显著降低,而在给予Mdivi-1后,这种共定位增加了40%。Western blotting分析表明,LC II/I比率在CIRI后显著增加,但在Mdivi-1给药后下降了36%。进一步分析表明,尽管p62总表达没有显著变化,但CIRI后p62从线粒体到细胞质的易位显著增加,并可以通过用Mdivi-1抑制Drp1活性来逆转这一过程。
这些结果表明,CIRI诱导的Drp1激活可能增强p62从线粒体中释放,并加速CIRI后自噬体的形成。
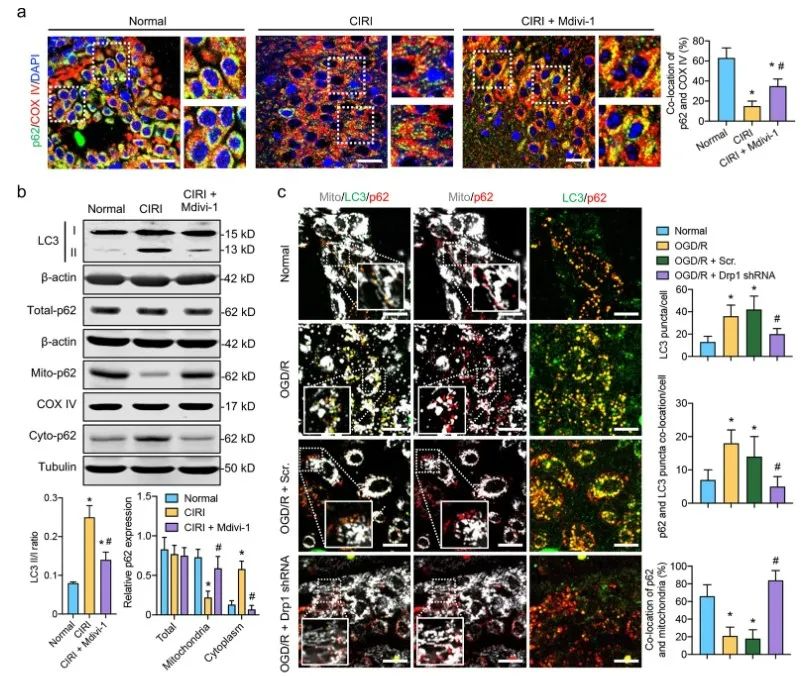
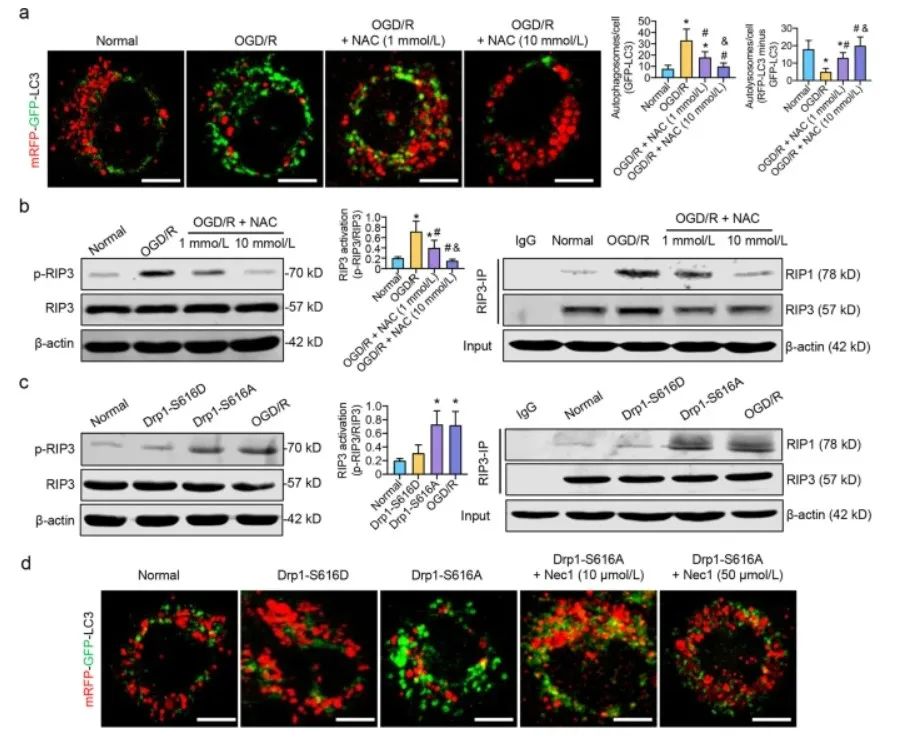
接下来,作者研究了mRFP-GFP-LC3获得的完整自噬通量。在OGD/R处理的SH-SY5Y细胞中,过多的自噬体(GFP-LC3)不能被溶酶体酸性环境消耗,“RFP-LC3 minus GFP-LC3”荧光的减少表明,p62-标记的自噬体在OGD/R后不能完全转化为自溶酶体。
用ROS清除剂NAC预处理OGD/R处理的SH-SY5Y细胞可能以剂量依赖性方式显著改善自噬体向自溶酶体的转化,表明p62介导的自噬通量可能与Drp1诱导的OGD/R后ROS积累有关。进一步发现,激活的Drp1诱导的ROS积累可能通过 RIP1/RIP3途径阻断自噬通量。
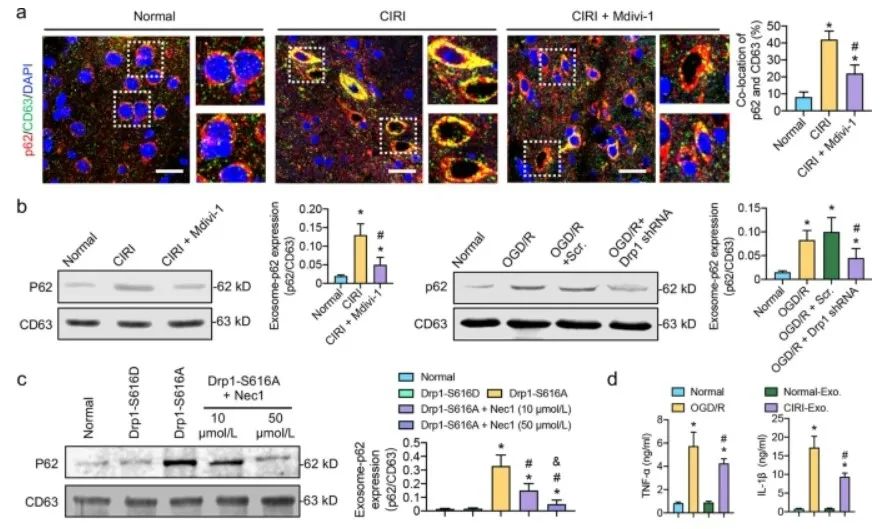
进一步研究发现,用CIRI衍生的外泌体刺激正常和OGD/R处理的SH-SY5Y细胞可以在一定程度上进一步激活RIP1/RIP3通路。同时,CIRI介导的外泌体对自噬体降解的阻断作用,也可能以剂量依赖的方式被RIP1/RIP3抑制剂Nec1抑制。这些结果表明,CIRI后外泌体刺激的炎症因子可能通过RIP1/RIP3通路进一步阻断自噬体降解,引发病理生理恶性循环。
五、总结
在这项研究中,作者发现激活的Drp1可能会加速p62介导的自噬体形成,并在 CIRI后通过RIP1/RIP3通路阻断自噬体降解。未降解的自噬体作为外泌体分泌到细胞外,引起炎症级联反应,进一步破坏线粒体,导致ROS积累加剧,阻碍自噬体降解,最终形成病理生理恶性循环。
但该研究也存在一定的局限性:
1)细胞模型使用 OGD/R 处理的 SH-SY5Y 细胞;研究结果是否也适用于其他脑组织细胞系,如 BV2 和 CIRI 临床样本,需要进一步验证。
2)除了经典的 p62 介导的线粒体自噬通路外,其他 LC3 结合受体是否也可能参与 CIRI 后 Drp1 调节的自噬通量,值得进一步研究。
3)由于目前外泌体检测方法的局限性,没有高时空分辨率特异性成像。
4)在实际场景中,脑缺血再灌注通常发生在脑血流被凝块阻断并被组织纤溶酶原激活剂 (t-PA) 恢复时。血凝块或t-PA将如何影响本研究的结论需要在临床试验中进一步研究。
尽管如此,这项研究表明,通过调节 RIP1/RIP3 通路加速 p62 自噬体转化和清除受损线粒体可能是改善 CIRI 病理生理学的有效措施。维持线粒体质量平衡和减少线粒体ROS积累(包括减少ROS生成和增加ROS清除率)可能是从根本上改善CIRI预后的关键。
来源:
https://mmrjournal.biomedcentral.com/articles/10.1186/s40779-022-00383-2#Sec22
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..