镰刀型细胞贫血症(SCD)是一种常染色体隐型遗传病。其发病原因为正常的血红蛋白HbA中β-珠蛋白基因发生了突变,使得蛋白链上的谷氨酸被缬氨酸所代替,HbA就变成了有害的血红蛋白HbS,导致红细胞僵硬、粘稠、变形性差、扭曲成“C”或“镰刀”状而得名。
由于SCD患者的红细胞变得僵硬和粘稠,导致流向各个器官的血流会被阻塞,从而造成多器官损害,患者可能出现贫血、反复感染、严重急性和慢性疼痛、免疫缺陷等。当粘稠的镰状红细胞阻断血液流动到了组织缺氧的程度就会出现血管闭塞危象(VOC),这会导致多器官衰竭,增加死亡几率。
作为全球最常见的单基因遗传病之一,每年大约有27.5万新生儿患有SCD。近年来,SCD发病率越来越高,年发病率约为1/300000,有机构预测到2050年,这个数字将增加到1/40000。迄今为止,SCD的治疗手段有限。药物方面,最早获批的仅有Hydroxyurea(羟基脲),由于Hydroxyurea会引起严重的毒副作用,并有致癌风险,因此使用受限。2017年,Emmaus Medical公司研发的Endari(L-谷氨酰胺口服粉剂)获FDA批准上市,用于治疗5岁及以上的SCD患者,成为近20年来第一个获批用于治疗SCD的药物。
2019年,两款治疗SCD的药物获FDA批准上市,分别是诺华的Adakveo(Crizanlizumab)和Global Blood Therapeutics(GBT)的Oxbryta(Voxelotor),Crizanlizumab是首款获批治疗VOC的靶向疗法,它是一种抗P-选择素单克隆抗体,能选择性结合内皮细胞表面和血管中血小板上的P-选择素,导致P选择素的阻断,抑制内皮细胞、血小板、红细胞、患病红细胞和白细胞之间的相互作用,而P选择素是VOC的主要驱动因素之一。2020年,Crizanlizumab在欧洲也获得了批准。但在今年1月份公布的III期临床试验中,crizanlizumab在两种不同剂量水平下与安慰剂相比,患者参与试验第一年里,导致就医的VOC的年化率没有统计学上的显著差异。也就是说,crizanlizumab在降低VOC的频率方面,未优于安慰剂。
Voxelotor则通过增加血红蛋白对氧的亲和力发挥作用。由于氧合的镰刀血红蛋白不聚合,Voxelotor能阻断聚合化及由此导致的红细胞镰状化和破坏。Voxelotor有潜力改善溶血性贫血和氧运输,并有可能潜在地改变SCD的进程。2019年12月,Voxelotor被FDA批准用于治疗≥12岁SCD儿童和成人患者的溶血性贫血。
除了药物治疗外,SCD患者还可以选择输血或造血干细胞移植。其中干细胞移植已被证明可治愈SCD,但是只有不到18%的患者能够找到匹配的捐赠者,而且在干细胞移植后,严重的排异反应往往也会让治疗效果大打折扣。
随着技术的发展,研究人员将目光投向了基因治疗,希望从根本上解决问题。基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,达到治疗目的。目前治疗SCD的基因疗法进展如下:
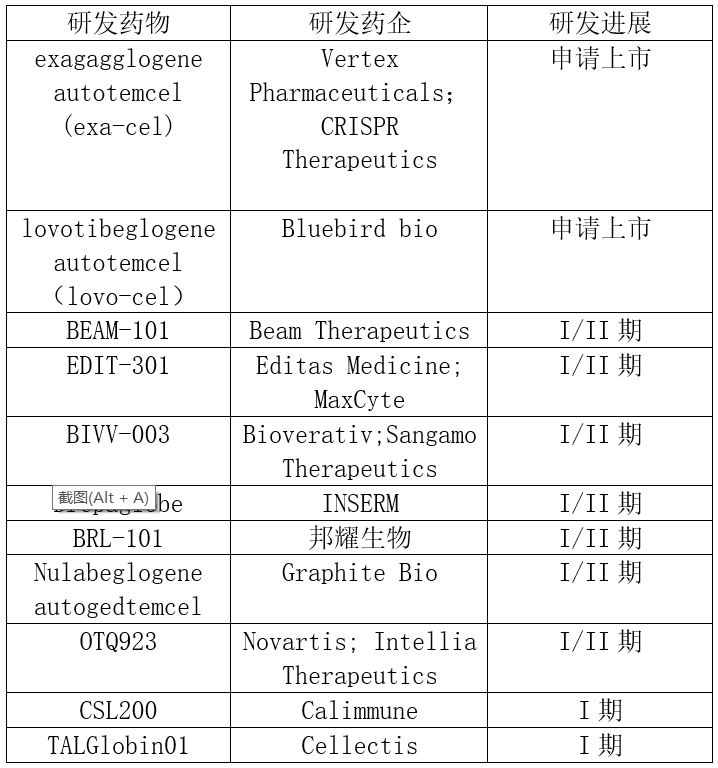
进入临床阶段的SCD基因疗法(来源:公开资料)
Vertex/CRISPR Therapeutics——exa-cel
Exa-cel是一款自体、体外CRISPR/Cas9基因编辑疗法。其通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白(HbF)。HbF可以携带氧气,在出生时自然存在。通过exa-cel治疗,可以提高HbF水平,从而减少SCD患者的疼痛和VOC发生频率。
在关键性临床试验CLIMB SCD-121中,共招募31例12-35岁的SCD患者,主要终点为至少12个月未发生VOC的患者比例。中位随访10.2个月后,试验结果显示,全部31例患者中均未发生任何VOC。血红蛋白中HbF平均占比在输注后提升至40%以上,并且能够长期维持。安全性方面,未发生exa-cel相关的不良事件。
此前,Exa-cel已获得FDA授予治疗SCD的再生医学先进疗法(RMAT)认定、以及快速通道和孤儿药资格。2022年9月,Vertex /CRISPR Therapeutics宣布,启动向FDA递交exa-cel的生物制剂许可申请(BLA)的滚动上市申请,用于治疗输血依赖性β-地中海贫血(TDT)和严重SCD。今年4月3日,Exa-cel完成了BLA滚动提交申请。

Bluebird bio——lovo-cel
lovo-cel是Bluebird bio研发的一种用于治疗SCD的一次性基因疗法,其设计目的是将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞中。一旦患者具有βA-T87Q珠蛋白基因,他们的红细胞可以产生抗镰状血红蛋白(HbAT87Q),从而降低HbS的比例,其目标是减少镰状红细胞、溶血和其他并发症。
此前,lovo-cel用于治疗SCD已获得FDA授予的孤儿药指定、快速通道指定、RMAT指定和罕见儿科疾病指定。今年4月24日,Bluebird bio宣布向FDA提交lovo-cel治疗12岁及以上有VOC病史的SCD患者的BLA。
Beam Therapeutics——BEAM-101
BEAM-101通过在体外对患者的造血干细胞进行基因组改造,使其模仿遗传性持续性胎儿血红蛋白症个体中的单核苷酸多态性,来缓解导致SCD的遗传突变的不良影响。BEAM-101于2021年11月获得了FDA的IND批准。和其他体外基因编辑疗法一样,BEAM-101也面临着与化疗清髓相关的毒性,为此,Beam公司的下一波SCD体外项目将对细胞的编辑方案进行调整,使得编辑后的细胞能够逃避抗体攻击。
Editas Medicine——EDIT-301
EDIT-301是一款体外基因编辑疗法,它由患者来源的CD34+造血干细胞和祖细胞组成,使用进行CRISPR基因编辑的新型Cas酶AsCas12a,对细胞编码胎儿血红蛋白的基因的启动子进行编辑。经过基因编辑的CD34+细胞可持续增加HbF生成。因此,此疗法具有通过一次性治疗,给SCD患者提供持续性缓解的潜力。
去年12月,Editas Medicine公布了EDIT-301的I/II期临床试验的初步结果:两名接受治疗的SCD患者均获得中性粒细胞和血小板定植,并且在随访过程中没有发生VOC。其中一名患者在接受治疗5个月时血红蛋白水平恢复到正常水平,超过95%的血红细胞中的HbF水平增加,血红细胞中的HbF水平超过了抑制血红细胞镰刀化的阈值。安全性方面,EDIT-301的安全性与自体造血干细胞移植的安全性特征相似,表现出良好的耐受性。
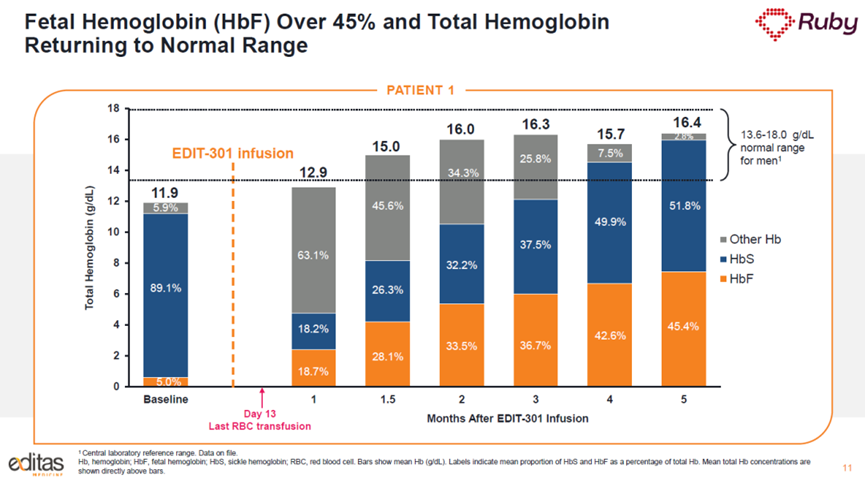
EDIT-301研究结果(图片来源:Editas公司官网)
SCD被称作“死神的镰刀”,同时SCD赛道也是基因治疗领域的一个缩影。基因疗法一直被认为与SCD可以相互成就,而引来多家药企重兵布局,其中有成功也有折戟沉沙。目前,哪款药物率先获批上市,哪款产品更有前景,尚无法做出判断。但随着众多药企在多条技术路线上的持续发力,SCD的临床需求正在得到缓解,患者也将迎来更多安全有效的治疗方案。
参考:
1.https://www.biospace.com/article/bluebird-s-scd-gene-therapy-released-from-partial-hold;
2.https://www.novartis.com/news/media-releases/novartis-sickle-cell-medicine-adakveo-approved-europe-prevent-recurrent-vaso-occlusive-crises;
3.《新药资讯:镰状红细胞病新药新药voxelotor获FDA批准上市》,医伴旅,2020-02-27;
4.EDIT-301 Phase 1/2 Study in Patients with Severe Sickle Cell Disease. Retrieved December 6, 2022, from https://ir.editasmedicine.com/static-files/10178590-881e-4c3b-b462-b0ce5be2ca26.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..