CAR-T疗法的研究如火如荼,作为肿瘤治疗的革命性疗法,CAR-T疗法的商业化进展已成为最受关注的焦点之一。到目前为止,全球共有8款CAR-T产品获批上市。其中,FDA批准上市的有6款,中国国家药品监督管理局批准上市2款。距最早一款CAR-T产品获批上市已经过去了5年,那么这些上市的CAR-T疗法表现如何呢?本文将对这些CAR-T疗法的适应症及临床数据做一汇总。
01
FDA批准的6款CAR-T疗法

表1:FDA批准上市的CAR-T疗法
1. Kymriah
诺华公司的Kymriah是一种CD19导向的CAR-T细胞免疫细胞疗法,也是全球第一款FDA批准上市的CAR-T疗法。
适应症:
(1)B细胞急性淋巴细胞白血病(ALL),用于治疗难治性或复发两次及两次以上的儿童和25岁以下成人。
(2)B细胞非霍奇金淋巴瘤(NHL),包括弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、高级B细胞淋巴瘤,用于至少接受两种全身治疗以上复发或难治性成人患者。
临床数据:
在ELIANA试验当中以Kymriah疗法治疗的79位病患,其5年总生存率(OS)为55%(95% CI:43-66),而5年无事件生存率(EFS)则为42%(95% CI:29-54)。试验长期追踪结果显示有82%(95% CI:72-90)的病患出现缓解。包含完全缓解(CR)或带有注射后3个月内出现不完全血液学恢复的完全缓解。病患的无复发生存率(RFS)则是49%(95% CI:34-62),而中位RFS尚未达到。在此长期追踪时间内,没有观察到新的或非预期的不良反应。这些结果显示,对这些之前仅具有限疗法选项的病患而言,Kymriah显示了其治愈此疾病的潜在可能性。
2.Yescarta
2017年10月,FDA批准了吉利德公司靶向CD19的CAR-T 疗法。这家大型制药公司在FDA批准Kite 的CAR-T细胞疗法Yescarta前几周收购了CAR-T开发商Kite Pharma。
适应症:
(1)B细胞非霍奇金淋巴瘤(NHL),包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、高级B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤,用于至少接受两种全身治疗以上复发或难治性成人患者。
(2)弥漫性大B细胞淋巴瘤:接受一线化疗没有效果或者一线化疗后1年内复发的成人患者。
临床数据:
在数据截止时,110例患者(86例滤泡性淋巴瘤患者,24例淋巴结边缘区淋巴瘤(MZL)患者)符合疗效分析条件。FL患者至少随访2年,MZL患者的最低要求为随访4周。在符合资格的FL患者中,中位随访时间为30.9个月(范围:24.7-44.3),客观缓解率(ORR)为94%、完全缓解率(CR)为79%,有57%的患者表现持续缓解。估计的中位缓解持续时间(DOR)为38.6个月、中位无进展生存期(PFS)为39.6个月,发生下一次治疗的中位时间为39.6个月,中位总生存期(OS)尚未达到,估计的24个月OS率(生存率)为81%。
在符合资格的淋巴结边缘区淋巴瘤患者中,中位随访时间为23.8个月(范围:7.4-39.4),ORR为83%、CR为63%。在数据截止时,50%的患者处于持续缓解状态。中位DOR和发生下一次治疗的中位时间尚未达到,中位PFS为17.3个月,中位OS尚未达到,估计的24个月OS率为70%。
3. Tecartus
2021年10月,吉利德的靶向CD19的细胞疗法Tecartus再次获得FDA批准。
适应症:
适用于成人复发性或难治性套细胞淋巴瘤(MCL)以及复发或难治性前体B淋巴细胞白血病(ALL)。
临床数据:
根据Kite Pharma公司新闻稿,该药本次在欧洲获批是基于ZUMA-3国际多中心、单组、开放标签、注册1/2期研究的结果。该研究针对的受试者群体为成人复发或难治性ALL患者。本研究最新数据显示,71%的可评估患者达到完全缓解(CR)或CR伴血液学不完全恢复(CRi),中位随访26.8个月。在所有关键给药患者的扩展数据集中,所有患者的中位总生存期超过2年(25.4个月),缓解者(达到CR或CRi的患者)的中位总生存期接近4年(47个月)。在疗效可评估患者中,中位缓解持续时间(DOR)为18.6个月。此外,本次试验的安全性结果与Tecartus的已知安全性特征一致。
4. Breyanzi
2021年2月FDA批准第4款靶向CD19的CAR-T细胞疗法。
适应症:
B细胞霍奇金淋巴瘤(NHL),包括弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤3B级、原发性纵隔大B细胞淋巴瘤等,用于复发性或难治性的成人患者。
临床数据:
基于TRANSCEND NHL 001研究的结果。该研究是在二线治疗后复发或难治性大B细胞淋巴瘤(R/R DLBCL、PMBCL、FL3B)患者中开展的最大规模关键试验,包括具有广泛组织学和高危疾病的患者。在216例接受Breyanzi治疗且疗效可评估的患者中,客观缓解率(ORR)为73%、完全缓解率(CR)为53%。病情缓解的患者中,中位缓解持续时间(mDOR)为20.2个月。在实现CR的患者中,mDOR为26.1个月。
5. Abecma
Abecma(idecabtagene vicleucel,ide-cel)是百时美施贵宝(BMS)与合作伙伴蓝鸟生物(Bluebrid Bio)研发的抗B细胞成熟抗原(anti-BCMA)导向的嵌合抗原受体(CAR)T细胞疗法。
适应症:
复发性或难治性多发性骨髓瘤,用于至少接受过四种治疗的成年人,包括CD38单克隆抗体、免疫检查点抑制剂等。
临床数据:
KarMMa研究的长期数据继续显示:中位随访超过2年(24.8个月),Abecma在R/R MM患者中具有持久的疗效和可预测的安全性。在128例患者中,中位总生存期(OS)为24.8个月,总缓解率(ORR)为73%,缓解持久。该研究中观察到的神经毒性(NT)特征的分析,加强了对Abecma安全性的充分了解,NT大多数为1/2级,且发生早、消退快。
6.Carvykti
Carvykti(西达基奥仑赛)是2022年2月FDA批准的第一款由中国企业南京传奇生物研发的靶向BCMA的CAR-T疗法。正是由于西达基奥仑赛在复发/难治多发性骨髓瘤中显示出卓越的抗癌活性及临床获益,才使得它成为中国首款获得FDA批准的细胞治疗产品,也是全球第二款获批靶向BCMA的CAR-T细胞免疫疗法。
适应症:
用于治疗复发或难治性多发性骨髓瘤(RR/MM)。这些患者在治疗前平均接受过5种前期疗法,76%的患者接受过5种治疗,86%的患者对5种疗法耐药,其中包括CD38治疗,而且对蛋白酶抑制剂PI和免疫调节剂IMiD双重耐药。简单说就是复发难治、后续缺乏有效的疗法。
临床数据:
此次获批是主要基于一项代号为CARTITUDE-1 1b/2期研究结果。这项数据非常振奋人心!参加临床实验的97例临床上已经没有更好治疗选择的晚期多发性骨髓瘤患者,在接受了传奇生物的这款CAR-T疗法后,出现了早期、深度持久的缓解。总缓解率(ORR)竟然高达98%(95%CI:92.7-99.7),更值得一提的是,78%的患者获得了严格的完全缓解(sCR,95%CI:68.8-86.1),这意味着即使是晚期患者,近80%在接受CAR-T治疗后,病灶也完全消失了!此外,12个月的无进展生存率(PFS)为77%(95% CI,66.0%-84.3%),总生存(OS)率为89%(95% CI,80.2%-93.5%)。
02
中国上市的两款CAR-T疗法
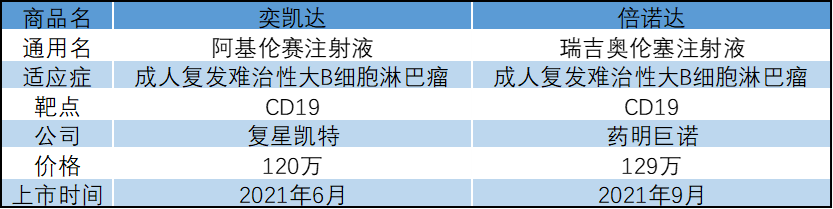
表2:中国上市的两款CAR-T
1.阿基伦赛注射液
阿基仑赛注射液是复星凯特2017年初从美国Kite(吉利德旗下公司)引进Yescarta (axicabtagene ciloleucel) 在中国进行技术转移,并获授权在中国进行本地化生产的靶向人CD19自体CAR-T细胞治疗产品。
适应症:
既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发性纵隔大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡性淋巴瘤转化的弥漫大B细胞淋巴瘤)
临床数据:
根据在101例复发/难治性LBCL患者中进行的单臂、多中心、开放性注册临床研究(ZUMA-1)结果,阿基伦赛具有卓越而持久的疗效和可控的安全性:1年随访结果显示:最佳总缓解率(ORR)为82%,完全缓解率(CR)达到了54%9;中位随访27.1个月,客观缓解率、完全缓解率和持续缓解率分别为83%、58%和39%2;随访≥4年(中位数,51.1个月),中位总生存期为25.8个月,4年总生存率达44%3。
2.瑞吉奥伦塞注射液
瑞基奥仑赛注射液(relma-cel,JWCAR029)是一种靶向CD19的自体CAR-T治疗产品,于2021年9月1日在我国获批上市。
适应症:
治疗经过二线或以上系统性治疗后复发或难治大B细胞淋巴瘤成年患者。
临床数据:
瑞吉奥伦塞注射液的关键性注册临床研究RELIANCE中,59例患者接受了relma-cel回输治疗,中位年龄为56.0岁。数据截至2020年12月31日,在58例可评估有效性的患者中,中位随访时间17.9个月,首次达完全缓解(CR)的中位时间为0.95个月,最佳客观缓解率(ORR)为77.6%,最佳CR率为51.7%。12个月总生存(OS)率为76.8%。安全性方面,relma-cel相关不良事件发生率低且可控,未发生药物相关死亡事件,≥ 3级细胞因子释放综合征(CRS)的发生率为5.1%,3级神经不良反应(NT)的发生率为3.4%,未发生≥4级NT。RELIANCE研究结果证实了relma-cel在我国患者中的疗效与安全性。
总结
不可否认,CAR-T细胞疗法在治疗血液癌症上具有显著疗效。但普通患者无法承担起昂贵的治疗费用。血液癌中的CAR-T治疗之所以行之有效,是因为它们是B细胞的恶性肿瘤,可以彻底清除掉,但是实体瘤没有B细胞等效物。静脉注射时,CAR-T细胞难以进入到实体瘤。更复杂的是,每种不同类型的器官都有不同的免疫微环境,这使得在不同类型的癌症患者中测试CAR-T成为一项挑战。
尽管如此,包括研究机构和生物技术公司,都在进行CAR-T治疗实体瘤进行各种研究。当地时间2022年11月21日,美国食品药品监督管理局(FDA)已批准传奇生物LB2102的新药临床试验(IND)申请。2022年1月科剂药业自主研发的CAR-T产品CT041被美国食品药品监督管理局(FDA)授予 “再生医学先进疗法” (RMAT)资格,用于治疗Claudin18.2 (CLDN18.2)阳性的晚期胃癌/食管胃结合部腺癌(GC/GEJ)。鉴于血液瘤取得的惊人成绩,我们期待CAR-T疗法在实体瘤的应用能有更多的突破。
数据来源:
1.诺华官网
2.百时美施贵宝官网
3.凯特生物官网https://www.kitepharma.com/news/press-releases/2022/9/kites-car-t-cell-therapy-tecartus-granted-european-marketing-authorization-for-the-treatment-of-relapsed-or-refractory-acute-lymphoblastic-leukemia
4.Bristol Myers Squibb Receives European Commission Approval for CAR T Cell Therapy Breyanzi (lisocabtagene maraleucel) for Certain Forms of Relapsed or Refractory Large B-cell Lymphoma
5.https://www.onclive.com/view/cilta-cel-induces-strong-response-in-chinese-patients-with-relapsed-refractory-multiple-myeloma
6.复星医药官网
7.瑞基奥仑赛注射液临床应用指导原则(2021年版),白血病·淋巴瘤, 2022,31(1) : 1-10. DOI: 10.3760/cma.j.cn115356-20211115-00262
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..