近期关于热点赛道CD19靶点药物喜讯不断。首个CD19靶向抗体偶联药物(ADC),Zynlonta治疗恶性淋巴瘤在欧盟进入审查,在中国进入2期临床。诺华复发/难治性滤泡性淋巴瘤新药!CD19 CAR-T细胞疗法Kymriah在美欧进入审查 ...
悄然间,CD19靶点集齐了ADC、单抗、双抗、CAR-T四大高手,同台打擂,热度比肩PD-1。一起纵观CD19靶点布局,探讨未来发展之路。
(一)CD19靶点简介
CD19是表达于B淋巴细胞及滤泡树突状细胞的表面蛋白,属于免疫球蛋白(Ig)超家族成员,位于16号染色体短臂上,分子量约95KD。细胞外有N端及两个C2-Ig区,一个跨膜区,细胞内有C端及含9个酪氨酸残基的高度保守功能区。
B细胞恶性肿瘤是常见的血液恶性肿瘤,尽管多数患者对目前的一线治疗有反应,但复发率高、预后差。
近年来,CD19作为B细胞恶性肿瘤免疫治疗的分子靶点受到极大的关注。
首先,CD19只在正常和恶性B细胞表达,几乎不在其他组织表达。
其次,CD19在B细胞恶性转化过程中不丢失,难治/复发性病例依然有效。
再次,CD19在造血干细胞和pro-B细胞不表达,治疗停止后,B细胞可以得到有效的补充。
凭借这些特点,以CD19为靶点治疗血液肿瘤的药物逐步崭露头角,并有望成为主流的临床治疗方法。
(二)CD19药物一览
(1)单抗
Viela Bio是一家专注于炎症和自身免疫性疾病领域的创新药物开发的制药企业,总部位于美国马里兰州。2020年6月11日,公司的抗CD19单抗Inebilizumab(Uplizna,MEDI-551)获FDA批准上市,用于治疗成人视神经脊髓炎谱系疾病 (NMOSD)。国内豪森拥有Inebilizumab的开发和商业化权益。
NMOSD 是一种罕见、严重、复发性的神经炎症性自身免疫疾病,以视神经和脊髓的炎性病变为特征。
Inebilizumab 在美国上市基于一项评估 Uplizna 疗效和安全性的 N-MOmentum 临床试验。该试验入组 230 位成年患者,其中有 213 名患者呈抗 AQP4 抗体阳性。
为期 197 天的研究显示,与安慰剂治疗组相比,接受 Uplizna 治疗的 161 名抗 AQP4 抗体阳性患者的 NMOSD 复发风险降低了 77%。
Inebilizumab作用机制
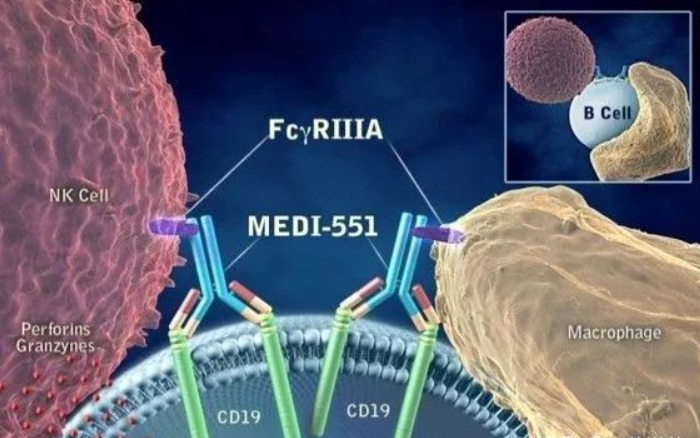
数据来源:Viela Bio
Tafasitamab是一款CD19单抗,由Xencor公司基于XmAb蛋白质工程平台开发,其所包含的XmAb工程化Fc结构域可以通过ADCC和ADCP介导B细胞裂解。
2020年7月,FDA批准Tafasitamab联合来那度胺治疗不适合自体造血干细胞移植的成人r/r DLBCL患者。试验结果显示,71名患者接受了治疗,ORR达55%(39/71),其中CR达37%,PR达18%,mDoR达21.7个月。
2021年8月,诺诚健华以3500万美元的首付款和最高8250万美元的里程碑费用获得Tafasitamab在大中华区的开发及商业化权力。
(2)双抗
靶向CD19的双抗获批时间远早于CD19单抗。
早在2014年,FDA即批准倍林妥莫双抗用于成人和儿童复发或难治性前体B细胞ALL患者。
倍林妥莫双抗(Blincyto,Blinatumomab,倍利妥)是一款双特异性CD19导向的CD3 T细胞衔接分子,原研为安进公司。
Blincyto一端可以与B细胞表面表达的CD19结合,另一端可以与T细胞表面表达的CD3结合。通过连接CD19恶性B淋巴细胞与CD3+T淋巴细胞,Blincyto可介导T细胞对肿瘤细胞的溶解。相对分子量为55KDa。
博纳吐单抗的获批主要基于TOWER试验,试验结果表明,Blincyto相比化疗显著改善r/r B-ALL成年患者的OS(7.7个月VS 4个月),12周完全缓解率为34%VS 16%,持续缓解时间(DOR)为7.3个月VS4.6个月。
在国内,百济神州拥有Blincyto在中国的权益。2020年10月31日,百济神州与安进建立全球肿瘤战略合作关系,在中国开发和商业化注射用Blincyto。
2020年12月,NMPA附条件批准Blincyto用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病(ALL)。
(3)CAR-T
目前,全球共6款CAR-T细胞疗法获批上市,其中五款均为CD19 CAR-T。
2021年,我国先后批准了CD19 CAR-T益基利仑赛注射液和瑞基奥仑赛注射液的上市申请。
益基利仑赛注射液是复星凯特从美国Kite Pharma(吉利德科学旗下公司)引进 YESCARTA技术、并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。
2021年6月,益基利仑赛注射液获NMPA批准,成为国内首款上市的CAR-T疗法,适应症为复发或难治性大B细胞淋巴瘤。
益基利仑赛注射液的获批基于关键性临床研究ZUMA-1的积极数据,2017年12月公布的1年随访结果显示:最佳总缓解率为82%,完全缓解率达到了54%;2018年12月公布的2年随访结果维中位随访27.1个月,仍有39%的受试者持续缓解,其中37%的受试者持续完全缓解。2019年12月公布了3年随访结果:中位随访时间39.1月,总生存率为47%,中位生存时间达到25.8月。
瑞基奥仑赛注射液是药明巨诺研发的一款以CD19抗原为靶点的自体CAR-T疗法。
2021年9月1日,国家药品监督管理局(NMPA)批准药明巨诺CAR-T药物瑞基奥仑赛上市,用于治疗复发/难治大B细胞淋巴瘤。
瑞基奥仑赛注射液的获批基于RELIANCE试验,试验结果表明,在58例可评估有效性的患者中,ORR达75.9%,CR达51.7%。中位随访时间8.9个月, 6个月DOR、PFS和OS分别为60.0%、54.2%和90.8%。
(4)ADC
Loncastuximab Tesirine(Zynlonta)是一款CD19 ADC药物,2021年4月获FDA批准上市,适应症为复发性或难治性大B细胞淋巴瘤成人患者。是全球第一个也是唯一一个获批的CD19靶向ADC。
Loncastuximab Tesirine由人源化抗人CD19单克隆抗体通过Linker与吡咯并苯并二氮杂卓(PBD)二聚体细胞毒素偶联而成。一旦与表达CD19的细胞结合,Zynlonta就会被细胞内化,随后释放出细胞毒素,该毒素能不可逆地与DNA结合,从而产生阻止DNA链分离的强力链间交联,从而破坏复制等必要的DNA代谢过程,最终导致细胞死亡。
Loncastuximab Tesirine的获批基于LOTIS 2试验,试验结果表明,Loncastuximab Tesirine3线及以上治疗DLBCL的ORR达48.3%,CR达24.8%。不良事件方面,由于不涉及T细胞激活,无CRS和NT毒性,主要的毒性为血液毒性。
在国内,ADC Therapeutics和瓴路药业于2020年底成立合资公司Overland ADCT BioPharma,共同开发Loncastuximab Tesirine。2021年3月2日,Loncastuximab Tesirine获CDE批准临床,目前处于临床Ⅰ期。
Zynlonta结构

数据来源:ADC Therapeutics
(三)结语
CD19是表达于B淋巴细胞及滤泡树突状细胞的表面蛋白,凭借其在B细胞表面高表达而在其他细胞表面低表达,以及治疗停止后,B细胞可以得到有效补充等优点,已成为B细胞淋巴瘤重要的治疗靶点。
目前,以CD19为靶点的单抗、双抗、ADC、CAR-T药物已相继上市,为晚期B细胞淋巴瘤患者提供了多种治疗手段。但是,在热闹研发的背后,也有观点认为针对CD19的研发已过于扎堆,火热的赛道背后是否是一场泡沫,研发的同质化问题值得深思。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..