近期,诺诚健华宣布将和 Incyte 公司达成合作,以 3500 万美元首付款+最高 8250 万美元里程碑付款+销售分成获得了靶向 CD19 的 Fc 结构域优化的单抗药物 Tafasitamab 在大中华区的开发和商业化权益。
诺诚健华自然不必多言,今年可谓是风头正盛,其接连获得了以高瓴为代表的资本巨头以及 Biogen 为代表的老牌 MNC 的青睐,未来前景被一致看好。交易的另一方也不会让人感到陌生,正是近些年和国内明星药企们合作频繁的位于美国特拉华州威尔明顿的 Incyte 公司。
这已经不是 Incyte 公司第一次和中国药企进行合作了,这家美国企业迄今已经与中国药企就不下 6 款产品的达成过合作,可谓是中国明星药企的老朋友了。
中国明星药企眼中的合作「香饽饽」
Incyte 和中国药企的故事开始于 2015 年,正是在那一年恒瑞与 Incyte 签订了卡瑞利珠单抗的合作开发协议。恒瑞将卡瑞利珠单抗除中国大陆、香港、澳门和台湾地区以外的全球独家临床开发和市场销售权利许可给了 Incyte,该笔交易总额合计 7.95 亿美元。协议签订后 30 天内 Incyte 向恒瑞支付了 2500 万美元的首付款,但在 2018 年该协议最终失败终止,终止原因被认为是卡瑞利珠单抗引起的微小血管瘤问题,Incyte 与中国药企的第一次合作也以这样的方式黯然告终。
卡瑞利珠单抗交易情况
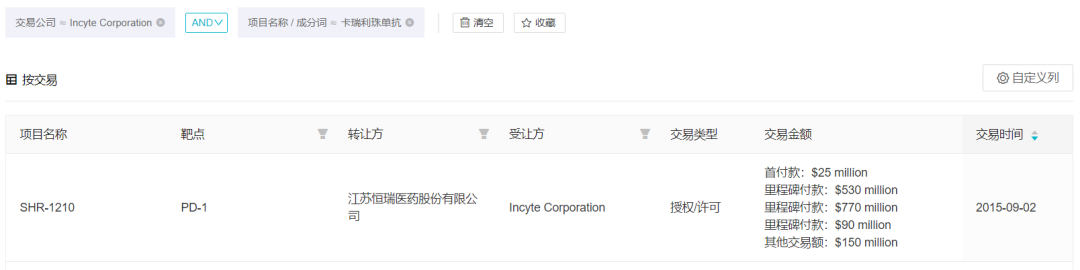
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
但这并没有影响 Incyte 和中国药企的紧密连接,紧接着在 2018 年,信达生物宣布和 Incyte 达成 License-in 战略合作和独家授权许可协议,推进 Pemigatinib(FGFR1/2/3 抑制剂)、Itacitinib(JAK1 抑制剂)及 Parsaclisib(PI3Kδ抑制剂)的单药或联合治疗在中国的商业化。根据合作协议规定,Incyte 公司将收到信达生物支付的 4000 万美元首付款,以及预计 2019 年在中国首次递交新药申请后的第二笔 2000 万美元现金付款,目前这些药物均在临床稳步推进中。
时间再来到 2019 年,再鼎医药也宣布和 Incyte 就一款处于临床阶段的抗 PD-1 单克隆抗体 Retifanlimab 达成授权许可协议。根据协议,再鼎医药将获得 Retifanlimab 血液和实体肿瘤适应症在大中华区(含港澳台)的独家开发商和业化权利,而 Incyte 将获得 1750 万美元的首付款,以及最高达 6000 万美元的潜在开发、注册和商业里程碑付款及大中华区销售分成。
就此,Incyte 公司的自主研发管线中处于前端的新药有一大半已经被国内药企 License-in 进了中国市场。从 2018 年到 2021 年,正是国内创新药企业 License-in 井喷时期,换句话说,Incyte 公司也见证了国内创新药企业的快速发展。而作为中国药企的老朋友,Incyte 的 2021 年似乎有些流年不利。
JAK 抑制剂审评屡遭延期,
Incyte 另辟蹊径
提到 Incyte 公司首先想到的就是该公司旗下的绝对的王牌产品——芦可替尼(Ruxolitinib)。芦可替尼是一款 JAK 抑制剂,2009 年诺华与 Incyte 达成合作协议,获得芦可替尼美国以外商业化权利,商品名为 Jakavi,Incyte 则负责芦可替尼在美国的开发和商业化权利。芦可替尼片最早于 2011 年 11 月首次在美国获批上市,目前其已获批 3 项适应症,分别用于治疗骨髓纤维化、真性红细胞增多症、移植物抗宿主病。
根据 Incyte 财报显示,芦可替尼在美国 2020 年销售额为 19.37 亿美元。诺华财报显示其在美国以外地区 2020 年的销售额为 13.39 亿美元,从销售额来看芦可替尼是一款当之无愧的重磅炸弹类药物。
在 2021 年开始之前,相信不论是 Incyte 公司还是资本市场对于芦可替尼的未来前景也都是一片乐观,然而进入到今年之后,芦可替尼正在面临一次前所未有的审查风波。
这一切都要从辉瑞旗下的 JAK 抑制剂托法替尼上市后安全性研究 ORAL Surveillance 未达到共同主要终点说起。众所周知,JAK 属于非受体蛋白酪氨酸激酶家族,JAK 共有 JAK1、JAK2、JAK3、TYK2 四种亚型,亚型之间有重叠的结合对象。目前 JAK1 已经成为炎症、癌症、免疫等疾病的靶点,JAK2 成为血液系统相关疾病的靶点,JAK3 成为自身免疫性疾病的热门靶点。
尽管是目前炙手可热的靶点,但值得注意的是安全性问题一直在困扰着研究者,这也是 JAK 抑制剂一直迭代的主要原因之一。属于第一代 JAK 抑制剂的托法替尼就不幸中招,其临床数据显示与 TNF 抑制剂相比,托法替尼具有非劣效性,换句话说,托法替尼的安全性仍存在一定问题。
城门失火,殃及池鱼。托法替尼的安全性问题也迅速波及到了同属第一代 JAK 抑制剂的芦可替尼,6 月 21 日 Incyte 宣布 FDA 已将芦可替尼用于治疗类固醇难治性慢性移植物抗宿主病(GVHD)监管申请的批准决定日期推迟了 3 个月。分析人士认为这不仅仅是审查延期的问题,在一定程度上也代表着 FDA 已经表露出对该类药物的安全性问题将采取更为严肃的态度。
对于 Incyte 公司更为不利的消息是芦可替尼并不是该公司旗下唯一被延期的 JAK 抑制剂,在 4 月 6 日,Incyte 旗下的另一款 JAK 抑制剂巴瑞替尼(Baricitinib)的一项补充新药上市申请(用于治疗成人中度至重度特应性皮炎)也遭到了 FDA 延期审查。
尽管目前所有的 JAK 抑制剂都面临着不同程度的延期审查风波,但这明显对于 Incyte 的冲击更大,因为 Incyte 比起其它赛道选手(辉瑞、艾伯维、吉利德)的天生劣势就是管线较为单一且目前对芦可替尼的依赖性较大,该公司第二季度的财报数据显示,芦可替尼为 Incyte 公司贡献了超过 75% 的收入。所以一旦未来 JAK 抑制剂遭到 FDA 的审查清洗,对 Incyte 的打击将是具有毁灭性的。
在这种情况之下,Incyte 已经做到了未雨绸缪。针对芦可替尼的安全性问题,Incyte 首先对其给药方式进行了调整优化,目前芦可替尼的给药方式为每日两次且呈不同强度给药,Incyte 目前正在开发一款每日给药一次的制剂,其预计在明年年底获得批准。此外,Incyte 对芦可替尼的剂型也进行了革新,一款全新的芦可替尼乳膏应运而生。
令人惊喜的是,芦可替尼乳膏在两项关键性 3 期临床试验中均达到了主要终点与关键次要终点,显著改善了白癜风患者面部与全身的皮肤症状。Incyte 将据此向 FDA 和 EMA 提交芦可替尼乳膏的白癜风适应症上市申请,此外,芦可替尼乳膏剂治疗治疗青少年和成人特应性皮炎的 NDA 目前正接受 FDA 审查。一旦芦可替尼乳膏顺利获得批准,其将成为首款能够帮助白癜风患者恢复皮肤色素的创新疗法,背后的巨额市场是不言而喻的。
危机与机遇并存,用来形容 Incyte 和芦可替尼是最恰好不过的。而就目前释放出的信号而言,Incyte 公司在对芦可替尼的未来大方向上已经做出了最优选择。
PD-1 药物惨遭拒批!
Incyte 将何去何从?
上文中已经提到,早在 2015 年 Incyte 就开始了与 PD-1 的故事,只不过这个故事在 2018 年就不得已提前宣布结束,Incyte 当然不会选择就此沉沦,其迅速以 9 亿美元从 MacroGenis 公司引进了另一款 PD-1 单抗药物 MGA012 所有适应症的全球开发和商业权利,包括支付 1.5 亿美元首付款,4.2 亿美元的临床开发和注册里程金,3.3 亿美元的商业开发里程金。
令人遗憾的是 MGA012,也就是后来的 Retifanlimab,在前不久刚刚被 FDA 拒绝批准,FDA 在完整回复函(CRL)中要求 Incyte 提供更多的数据以证明其临床收益,此消息一出 Incyte 股价立即遭遇跳水,在这一个月的时间里跌跌不休,至今没有缓过劲来,目前其股价相较于年初已经下跌了 30% 左右。
今年 1 月,Incyte 宣布递交了 BLA 申请并获得优先审评资格,Retifanlimab 将拟用于治疗疾病进展或对铂类化疗不耐受的局部晚期或转移性肛管鳞状细胞癌(SCAC)成人患者。Retifanlimab 的申请是基于一项针对 94 名二线肛管鳞状癌患者的单臂实验数据,对这一适应症而言,目前还尚未有相应药物获批,所以可以认为 Incyte 对 Retifanlimab 的获批是具有一定信心的。
但根据 FDA 表示,临床数据显示 Retifanlimab 的客观缓解率(ORR)仅为 14%,远低于最初 Incyte 预期的 25%。除此之外,FDA 还对研究的对象人群表示担忧,因为临床试验纳入的患者数量较少,FDA 认为目前不能确定潜在收益是否远超可能带来的免疫不良反应。
不过 FDA 并没有直接对 Retifanlimab 处以死刑,FDA 要求 Incyte 公司继续完成 3 期临床研究,在确证 Retifanlimab 有效性后再递交上市申请,这也是 FDA 考虑到目前 SCAC 治疗尚未有新药获批的窘境而对 Retifanlimab 略为宽容,换句话说,尽管即将陷入绝境沼泽,但 Retifanlimab 仍有希望能够重新上岸。
从 Incyte 对 Retifanlimab 的适应症布局来看,其明显选择了一条差异化之路,避开了 PD-1 药物竞争激烈的主流适应症转而瞄准了更为小众的适应症,此次 Retifanlimab 以 SCAC 打头阵,没想到迅速遭遇了滑铁卢。可能连 Incyte 自己也不会想到,在挥舞着巨额钞票接连引进 PD-1 药物以及对适应症精心布局之后会迎来这样一个结局。
而更为值得思考的,是 Retifanlimab 此次被拒绝批准后将会引发怎样的蝴蝶效应。首先因为 PD-1 这个靶点的特殊性,注定了其可以与众多靶点药物联用,纵观 Incyte 的研发管线,其对 PD-1/CD137 双抗、TIM3、LAG 靶点均有布局,而这些靶点目前也是与 PD-1 药物联用的大热门,此次 Retifanlimab 的拒绝批准势必将影响其他管线的推进,对管线本就较为单一的 Incyte 来讲将会造成不小的挑战。
Incyte 公司研发管线
此外 Retifanlimab 的大中华区开发权益被再鼎医药收入麾下,此次被 FDA 拒绝批准在未来会不会影响到其在中国的获批以及商业化前景,这是一个令人极其关注的问题,但至少就目前来看该药物在中国的前景也是可以打上一个问号的。
根据 Insight 数据库,目前 Retifanlimab 已经在中国启动 3 项临床试验,适应症涵盖了子宫内膜癌、非小细胞肺癌等热门适应症,在临床试验开发全面铺开的情况下,此次出师不利将对 Incyte 和再鼎医药的下一步举措蒙上了一层迷雾。
Retifanlimab 在国内启动的临床试验

来自:Insight 数据库(http://db.dxy.cn/v5/home/)
如何挽救已经花费巨额代价的 Retifanlimab?这个问题将在未来很长的一段时间内困扰 Incyte 公司,其能交出一份怎样的答卷,也请拭目以待。
小结
打开 Incyte 公司的官网首页,有一句简短的「Solve On」赫然在列,这句话也是 Incyte 公司的企业信条,为科学以及患者提供解决方案是 Incyte 这些年所不断追求的,然而现在却到了 Incyte 该为自己找到一条「Solve On」的路的时刻了。
说 Incyte 目前站在悬崖的边上或许太过夸张,但其目前的确是处于迷雾之中,而作为中国的老朋友,在大洋彼岸的我们能做的,唯有祝福。
参考资料
1. Incyte 官网及公开资料;
2. Incyte the latest to fall victim to JAK scrutiny as FDA pushes back Jakafi review in GVHD;
3. 辉瑞、礼来后,又有一款 JAK 抑制剂被 FDA 延迟审查。恒瑞、信达也悉数入局,安全性难题至今未破……;
4. Insight 数据库
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..