疾病治疗可以分3个层面,除了最常见的作用于蛋白功能层面的各类小分子、抗体药物等,以及被认为是终极方案的基因层面的治疗之外,还有一类介于基因转录发生之后、蛋白质生成之前的RNA水平的治疗。
一场mRNA新冠疫苗的“东风”,催着RNA药物开始欣欣向荣。据EvalutePharma和BCG预测2024年RNA治疗市场规模将达到86亿美元,2018-2024年的年复合增长率可达35%。
那么RNA药物能在哪些领域治疗疾病,已经取得哪些市场成果,上市之后一定优于蛋白层面的治疗药物吗?本文带您一起了解。
01
RNA药物的技术分类
提到RNA药物,人们最熟悉的当属被FDA紧急授权使用的mRNA新冠疫苗。若按CB Insights的分类标准看,mRNA疫苗属于以编码蛋白质为目的的RNA药物,此外还有另外两类RNA药,它们分别是:(一)以RNA为靶点的,主要有单链的反义寡核苷酸药物(ASO)、双链的RNA干扰药物(RNAi);(二)利用RNA自身的空间结构,靶向蛋白质的RNA分子药物,RNA适配体药物就属于这一分类。
2004年,FDA曾批准过1款适配体RNA药物。近年来获批的都是以RNA为靶点的ASO、RNAi(以siRNA为主)药物。获批药物的研发公司也非常集中,4款siRNA药物全部被Alnylam垄断,ASO药物基本被Ionis和Sarepta瓜分。
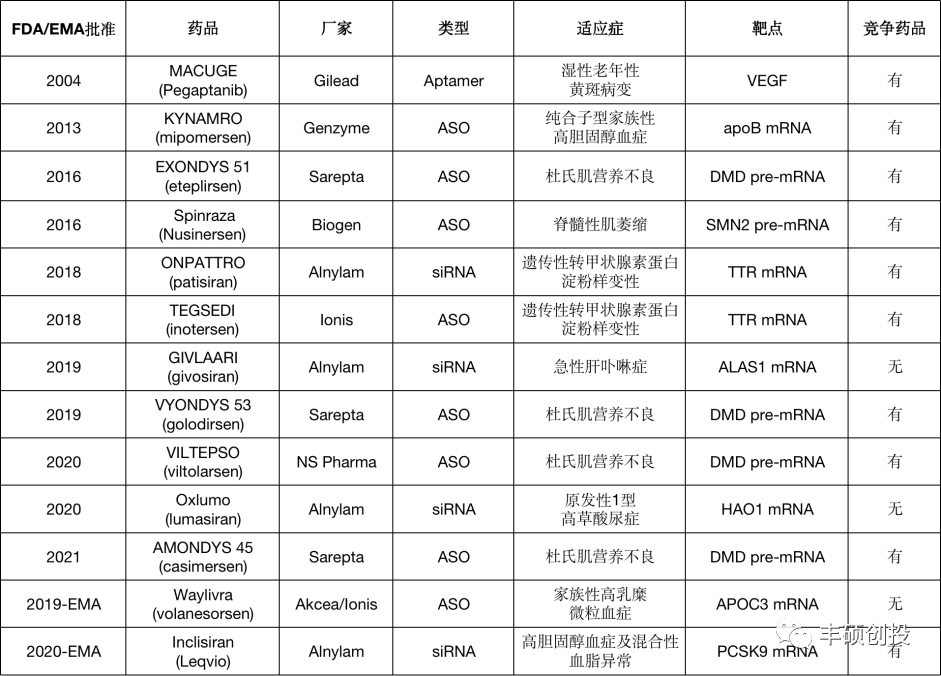
图 1 近年来获批的RNA药物
(公开资料,丰硕创投整理)
siRNA药物的作用机理
RNA干扰是抵御外源基因入侵的自然过程,获得过2006年诺布尔生理学或医学奖。具体过程是外源导入或者由转基因、病毒感染等各种方式引入的双链RNA,一旦进入细胞内就会被一个称为Dicer的酶切割成为21-23个核苷酸长度的片段RNA,即小干扰RNA(siRNA)。该siRNA片段解旋成单链RNA后,会与一系列酶结合形成诱导沉默复合体(RISC)。RISC再通过碱基配对与siRNA互补的内源mRNA结合,如果这种结合具有特异性,那么内源mRNA就会被内切酶切割成无法翻译的RNA碎片;如果结合不具特异性,RISC复合物就粘在mRNA上,阻止核糖体在内源mRNA上的移动和翻译,使基因表达沉默。
所以,siRNA是双链结构,通过专门将其中一条链设计成与突变基因编码的特定蛋白质的mRNA互补,模拟RNA干扰这一自然生物过程来治疗特定的疾病。当然,也可以靶向和提高与疾病通路相关的其他非致病蛋白(即不是由单个基因突变引起的蛋白)的水平来提供治疗益处,理论上也可以直接靶向并破坏病毒RNA从而解决传染性疾病。
ASO药物作用机理
ASO是化学合成的单链核苷酸分子,通常设计为长度在13-30个核酸序列的与靶向基因序列互补的短片段。ASO与目标RNA精确结合后,通过以下几种常见的作用机制 ①通过激活内源性RNA酶促反应对目标mRNA的降解;②与mRNA的翻译起始点结合,抑制翻译;③抑制天然反义转录本(NATS)的功能;④改变剪切体的剪切位置,来阻止致病蛋白质的产生。
ASO独特的单链结构使得它们可以直接与mRNA结合,可以通过几乎所有的给药途径来实现治疗,减少药物对身体其它部位的暴露。
适配体RNA药物的作用机理
适配体RNA药物是一种短单链寡核苷酸,利用其三维结构特异性地与蛋白质结合,类似抗体药物。适配体具有体积小、较低免疫原性、无细胞化学合成以及较强组织穿透力等优点。但可能因为它们不能高浓度表达,从而无法有效调节蛋白质功能的原因,适配体技术没有像其他RNA技术那样获得广泛应用。
02
治疗非基因疾病的情况
湿性老年性黄斑病变(wAMD)
黄斑变性不是基因疾病,发病原因尚未明确,通常认为是高龄退化的自然结果。湿性AMD的主要病理基础是脉络膜新生血管化,而血管内皮生长因子(VEGF)已被证实在脉络膜新生血管形成中起重要作用。
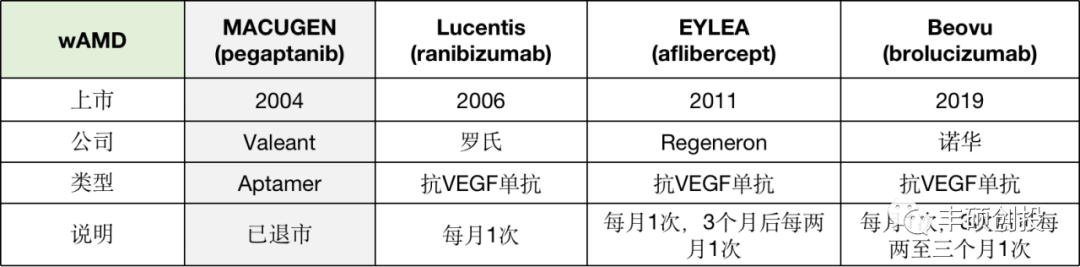
图 4 治疗wAMD的主要药物
(公开资料,丰硕创投整理)
2004年FDA批准了全球首款适配体RNA药物Macugen,它靶向VEGF的一个异构体VEGF165。但在Lucentis单抗上市后,Macugen因为疗效不突出,销售情况不佳。随后Eylea单抗与Beovu单抗上市,市场竞争更激烈,这款RNA适配体药物出局,目前已经退市。
而关于适配体技术,在两项临床试验Fovista(抗PDGF适配体)和Reg1(抗FIXa适配体)相继失败后,已经逐渐没落。目前临床的在研药物大约只有12种。
人们最早关于适配体的认识“抗体能做的事情,适配体都能做,即使不一定更好,但可以应用到更广泛的靶点上”,这个预期并没有如愿实现,目前依然是抗体药物大步前进在治疗复杂疾病的道路上。
03
治疗基因疾病的情况
1、纯合子型家族性高胆固醇血症(HoFH)
家族性高胆固醇血症是由分解代谢低密度脂蛋白胆固醇(LDL-C)的关键基因的纯合或杂合突变导致的。已知四种基因突变可致病,即前蛋白转化酶枯草杆菌蛋白酶9(PCSK9)、LDL受体、LDL受体衔接蛋白1(LDLRAP1)、载脂蛋白B(apoB)。其中最常见的是LDL受体基因突变。
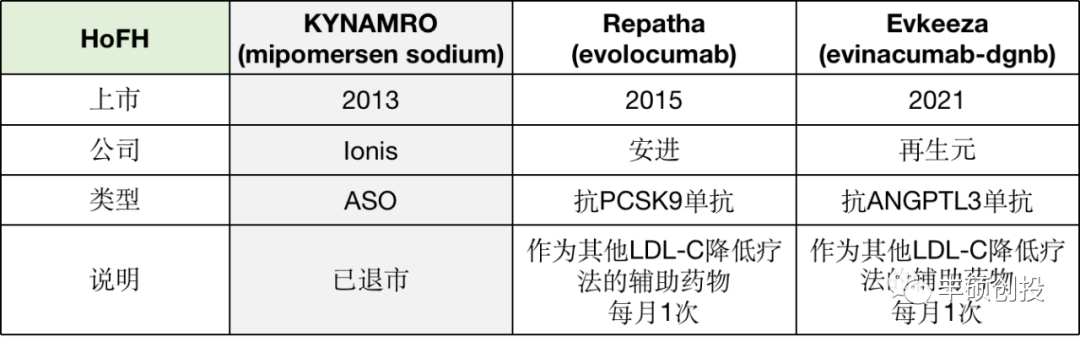
图 5 治疗HoFH的主要药物
(公开资料,丰硕创投整理)
FDA在2013年最早批准了Ionis公司开发的ASO药物Kynamro,它靶向apoB-100 mRNA,由于存在肝脏毒性的黑框警告,临床使用受到限制,目前也已经退市了。
随后获批的两款药物均为单抗产品。2015上市的Repatha靶向PCSK9,在为期5年的临床研究中表现出了降低LDL-C水平的持久性以及长期的有效性和安全性。今年刚获批的全人源单抗Evkeeza,靶向ANGPTL3(血管生成素样蛋白3,是肝脏分泌的一种蛋白)。
2020年时,EMA批准了一款siRNA药物Inclisiran(Leqvio),但是用于治疗杂合子型的,通过靶向PCSK9的mRNA,抑制PCSK9蛋白生成,从而达到治疗效果。
所以,在HoFH疾病上,ASO同样被抗体药物打败。目前治疗该疾病的临床已无ASO身影。而siRNA药物Inclisiran与单抗Repatha在同靶点PCSK9的竞争下会怎样,还需要等待更多的数据。
2、脊髓性肌萎缩症(SMA)
SMA是单基因遗传性疾病,主要原因是SMN1基因突变导致的运动神经元存活蛋白(SMN)水平低。人体还有一个序列极其相近的SMN2基因可以救急,只是该基因表达时会缺失7号外显子,导致蛋白略短,很快被降解。
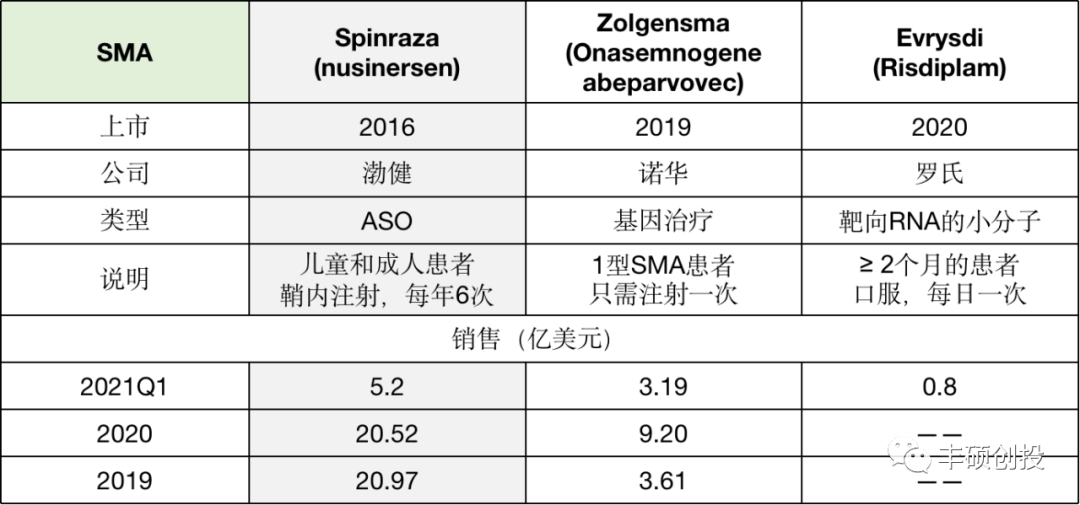
图 6 治疗SMA的药物
(公开资料,丰硕创投整理)
FDA最先批准了渤健公司开发的ASO药物Spinraza,它通过与SMN2基因的前体mRNA结合,促进其7号外显子编入成熟mRNA中,产生功能类似SMN1的蛋白。它已为渤健带来了累计约50亿的收入,可以说是迄今为止ASO药物中最成功的一款。
不过在2019年,基因治疗药物Zolgensma获FDA批准上市后,立刻扼制了Spinraza的市场增长。Zolgensma直接注射人类正常SMN基因解决遗传根源,只需单次注射,不像Spiraza需要每年鞘内注射6次。
最近又有一款靶向RNA的小分子药物Risdiplam上市,机理类似于Spiraza。但Risdiplam是小分子,在用药上有优势,可口服,能够穿透血脑屏障,同时提高中枢和外周SMN蛋白水平。根据今年一季度的销售数据,罗氏公司称其在美国市场表现出了强劲的渗透速度。
在治疗效果上,小分子Risdiplam和基因治疗Zolgensma相当,比ASO药物Spinraza略好。所以ASO药物Spinraza销售走下坡路的前景基本明了。在SMA这个单基因疾病上,ASO药物的领先持续得稍显短暂。
3、杜氏肌营养不良症(DMD)
DMD是由X染色体上的DMD基因发生无义突变,产生提前终止密码子,使mRNA翻译提前终止,所生产的蛋白不能正常发挥作用,很快会被降解。通常的治疗手段是采用外显子跳跃疗法,即通过药物与突变处结合,“遮蔽”该处无义或者终止的信号,使核糖体继续翻译,虽然产生的蛋白是短的,但是保存了部分功能。
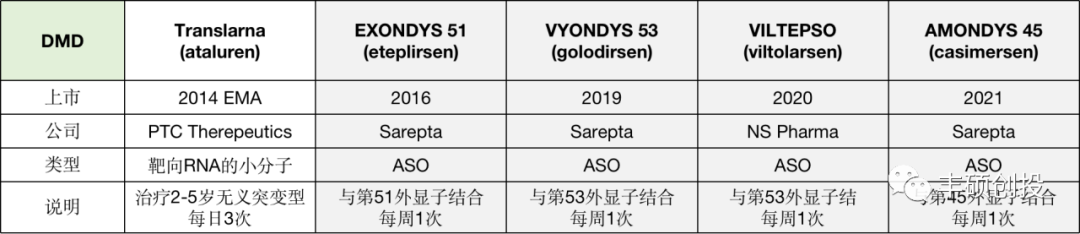
图 7 治疗DMD的药物
(公开资料,丰硕创投整理)
近年来,DMD治疗领域持续产生了很多ASO药物,几乎都由Sarepta公司研发,这也反映出ASO药物开发技术可以成为一种可重复的技术平台。
不过Exondys 51和Vyondys 53对肌营养蛋白的改进平均只比基线增加了0.1%和0.88%,且因怀疑肾毒性和感染风险,FDA审查人员曾不建议批准,最终因患者的迫切需求而上市。不过今年新上市的Amondys 45结果较之前的有明显改善。这三款产品联合起来已可以为30%的DMD患者提供治疗选择。
DMD是一个活跃的研究领域,目前ASO已成为主流的治疗药物。不过临床上辉瑞有一款基因疗法已进入3期,未来可能会形成有力的竞争。
04
国内情况与展望
相比而言,国内RNA药物研发公司的技术还不太成熟。除了艾博生物(与沃森生物)的mRNA新冠疫苗已进入临床3期以外,瑞博生物和圣诺生物算是RNA干扰药物研发的领军者,已有几款药物进入临床研究阶段。继5月份瑞博生物港股IPO终止后,圣诺生物于近日公开了港股招股书。
生物医药技术通常更新迭代得很快,所以竞争经常会在不同的维度上展开。不过市场永远是检验产品的金标准,mRNA新冠疫苗的爆发虽然占了天时地利之巧,但是也基于它拥有极高的保护率这个过硬的实力。其余技术类型的RNA药物还需在治疗效果、减少副作用、疾病差异化等方面寻求改进,才可在市场上拥有较长的生命周期,避免被基因治疗、单抗等药物的围堵以及过快的替代。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..