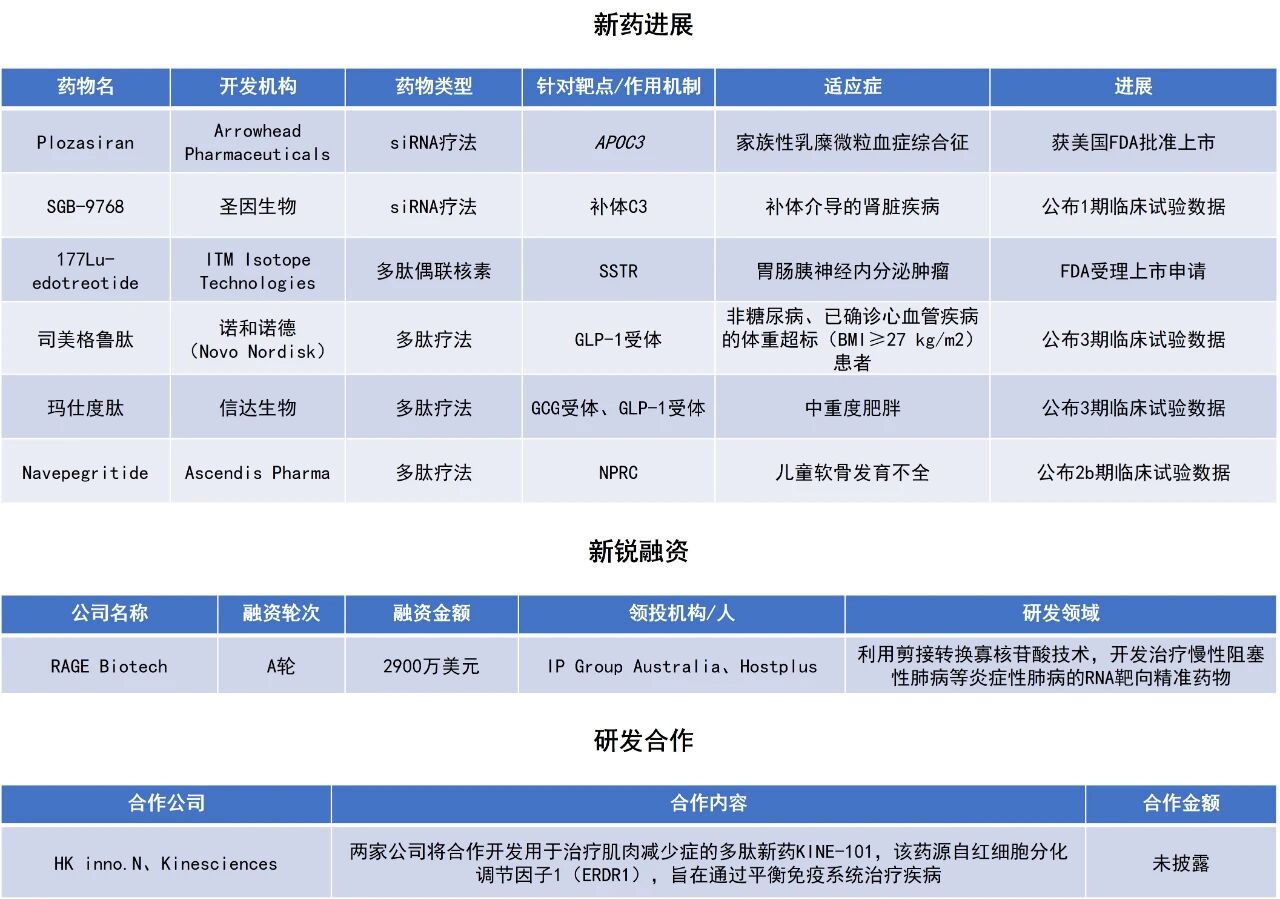
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。Arrowhead Pharmaceuticals公司的RNAi疗法Redemplo(plozasiran)获美国FDA批准作为饮食控制的辅助治疗,用于降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯(TG)水平。《柳叶刀》上发表的司美格鲁肽的一项3期临床试验预设分析结果显示,该药的大部分心血管保护作用是通过独立于脂肪减少的其他机制实现的。GCG/GLP-1双受体激动剂玛仕度肽注射液在中国中重度肥胖人群中开展的一项3期临床研究达成主要终点和所有关键次要终点,即将递交新药上市申请。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Plozasiran:获美国FDA批准上市
Arrowhead Pharmaceuticals宣布,美国FDA已批准Redemplo(plozasiran),作为饮食控制的辅助治疗,用于降低家族性乳糜微粒血症综合征成人患者的TG水平。Redemplo是一款靶向APOC3基因的“first-in-class”RNAi疗法,基于Arrowhead专有且具差异化的Targeted RNAi Molecule(TRiM)平台所开发。APOC3是富含甘油三酯脂蛋白(TRL)的组成部分,也是甘油三酯代谢的关键调节剂。APOC3通过抑制脂蛋白脂肪酶分解TRL以及肝脏受体吸收TRL残留物来增加血液中的甘油三酯水平。Redemplo治疗目标是通过下调APOC3降低甘油三酯水平,并将脂质恢复到更正常的水平。在多项临床研究中,该疗法显示可降低FCS、严重高甘油三酯血症(SHTG)和混合性高脂血症患者的甘油三酯和多种致动脉粥样硬化脂蛋白。根据新闻稿,Redemplo是首款获得FDA批准用于FCS患者的siRNA药物,可通过简单的每三个月一次皮下注射在家中自行给药。
FDA的批准主要基于3期PALISADE研究的临床数据,该研究是一项在经临床诊断或遗传学确认的FCS成人患者中开展的随机、双盲、安慰剂对照试验。分析显示,PALISADE研究达到了其主要终点和所有关键次要终点,包括显示甘油三酯及APOC3水平显著下降。在PALISADE研究中,25 mg Redemplo实现了显著且持久的甘油三酯降低,中位数相较基线变化为-80%,而安慰剂数据合并组为-17%;且与安慰剂相比,急性胰腺炎发生率在数值上更低。Redemplo治疗患者中最常见的不良反应(发生率≥10%且较安慰剂多>5%)包括高血糖、头痛、恶心和注射部位反应。
司美格鲁肽:公布3期临床试验数据
近期,在学术期刊《柳叶刀》上发表了司美格鲁肽的一项3期临床试验SELECT的预设分析结果。SELECT试验针对非糖尿病、体重超标(BMI≥27 kg/m2)且已确诊心血管疾病的人群,共纳入全球41个国家、804个中心的17604名患者。研究将患者随机分组接受每周一次皮下注射的司美格鲁肽(2.4 mg,前16周剂量递增)或安慰剂,平均随访时间近40个月。
此前的结果已显示,司美格鲁肽相比安慰剂可降低20%的重大不良心血管事件(MACE)风险(MACE定义为心血管死亡、非致死性心梗或非致死性卒中的复合事件)。本次预设分析进一步探讨了基线肥胖指标(体重、腰围)及其变化与心血管结局之间的关联。结果显示,在不同基线体重和腰围水平的患者中,司美格鲁肽的心血管保护作用高度一致,未见异质性。此外,司美格鲁肽给患者带来的心血管获益,与患者基线脂肪含量及体重减轻幅度也无明显线性关联,而腰围变化虽有一定介导作用,也仅能解释约三分之一的效果。
此前,大量证据显示内脏脂肪比外周脂肪对代谢和炎症不良影响更大。此次该研究的结果提示,中心性肥胖的减少可能有助于司美格鲁肽的心血管获益。同时,大部分心血管保护作用是通过独立于脂肪减少的其他机制实现的——研究者推测,其中的作用可能包括直接改善内皮功能、抗动脉粥样硬化、调节全身炎症反应、降低血压与血脂等。
玛仕度肽:公布3期临床试验数据
信达生物宣布,其GCG/GLP-1双受体激动剂玛仕度肽注射液在中国中重度肥胖人群中开展的3期临床研究GLORY-2达成主要终点和所有关键次要终点,该公司将于近期向监管机构递交玛仕度肽9 mg用于成人体重控制的新药上市申请。
此次公布的结果显示,在治疗期内,玛仕度肽组受试者平均体重持续下降,第60周时仍未达平台。第60周时,玛仕度肽9 mg组受试者平均体重降幅为18.55%,安慰剂组为3.02%;玛仕度肽9 mg组受试者中44.0%实现20%及以上的体重降幅,安慰剂组这一比例为2.6%(P值均<0.0001)。研究的关键次要终点结果表明,在不合并2型糖尿病的受试者中,第60周时,玛仕度肽9 mg组受试者平均体重降幅为20.08%,安慰剂组为2.81%;玛仕度肽9 mg组受试者中48.7%实现20%及以上的体重降幅,安慰剂组这一比例为3.1%(P值均<0.0001)。
此外,玛仕度肽9 mg在腰围、收缩压、甘油三酯、非高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和血尿酸等关键次要终点的改善均显著优于安慰剂。该研究在部分受试者中进行了基于磁共振成像-质子密度脂肪分数(MRI-PDFF)的肝脏脂肪含量评估。在基线肝脏脂肪含量≥10%的非糖尿病受试者中,第60周时玛仕度肽9 mg组肝脏脂肪含量较基线的平均百分比降幅为71.9%,安慰剂组升高5.1%。
安全性方面,玛仕度肽9 mg的耐受性和安全性良好,未发现新增安全性信号。胃肠道不良反应大多为轻度或中度,且呈一过性。玛仕度肽9 mg组和安慰剂组因不良事件提前终止治疗的受试者比例分别为2.9%和0%。
177Lu-edotreotide:FDA受理上市申请
ITM Isotope Technologies公司宣布,美国FDA已受理该公司对n.c.a. 177Lu-edotreotide(又称ITM-11或177Lu-edotreotide)递交的新药申请(NDA)。177Lu-edotreotide是ITM自主研发的合成靶向放射性治疗在研药物,拟用于治疗胃肠胰神经内分泌肿瘤(GEP-NETs)。FDA已将该申请的PDUFA日期设定为2026年8月28日。
177Lu-edotreotide由镥177(一种发射β射线的放射性同位素)和edotreotide组成。Edotreotide是一种生长抑素受体(SSTR)激动剂。此次NDA递交主要基于3期COMPETE研究的结果。该研究为前瞻性、随机、对照、开放性试验,入组309例不可手术、进展性1级或2级GEP-NETs患者,旨在评估177Lu-edotreotide作为一线或二线治疗方案的疗效与安全性。试验达到主要终点:与靶向疗法活性对照组相比,177Lu-edotreotide治疗组的中位无进展生存期(mPFS)显著延长。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..