近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。新型癌症免疫疗法ELI-002 7P的2期临床试验数据亮眼,在近100%携带KRAS突变(mKRAS)的胰腺导管腺癌患者中诱导了mKRAS特异性T细胞应答。潜在“first-in-class”溶瘤肽VP-315在一项针对基底细胞癌患者的2期研究中,事后分析的客观缓解率达97%,组织学完全清除率达51%。Ionis Pharmaceuticals公司的Dawnzera(donidalorsen)获欧洲药品管理局(EMA)推荐上市,用于预防12岁及以上成人和儿童患者的遗传性血管性水肿(HAE)发作。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
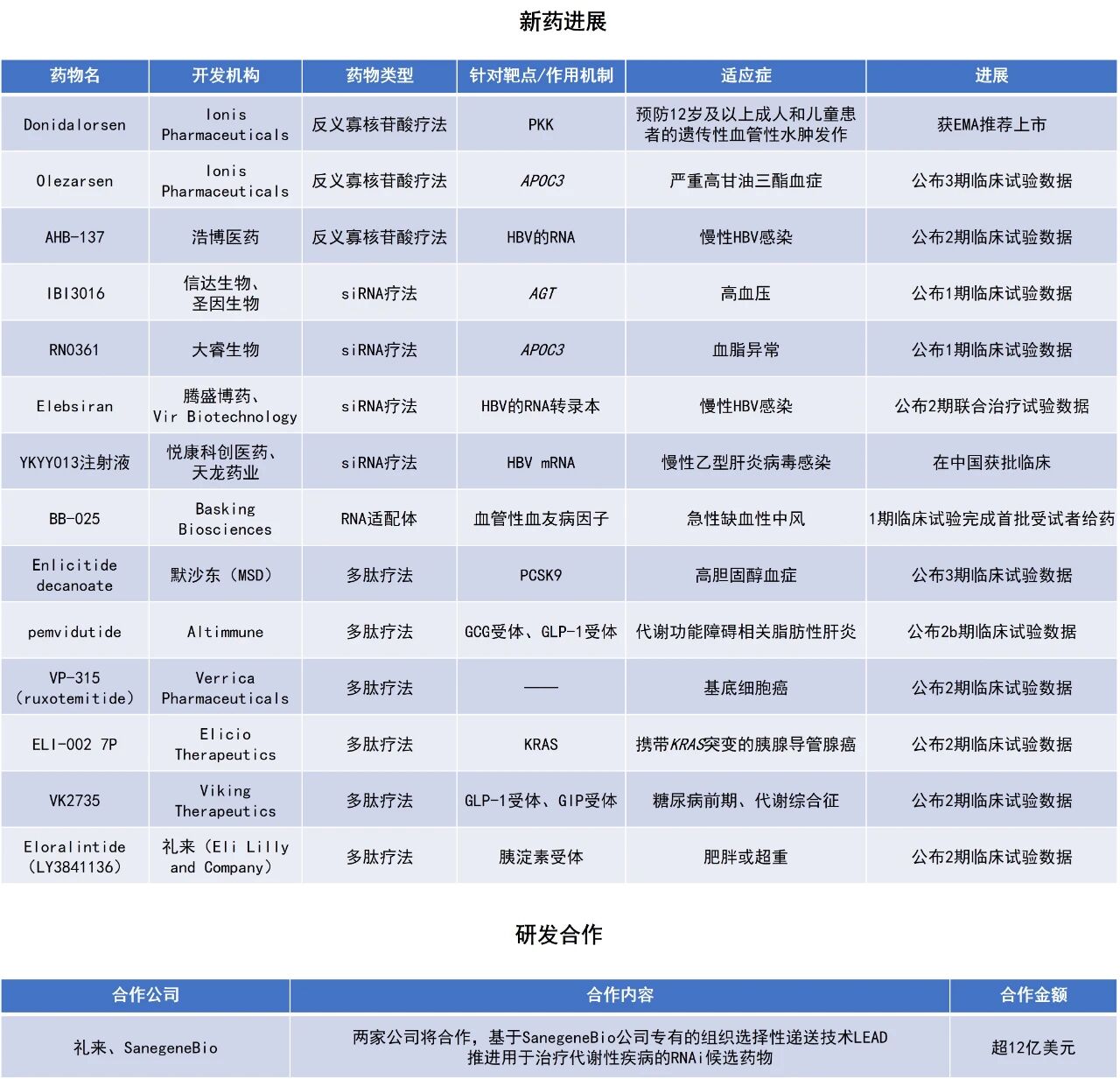
ELI-002 7P:公布2期临床试验数据
Elicio Therapeutics公司公布了其正在进行的2期AMPLIFY-7P试验中,ELI-002 7P用于治疗携带mKRAS的胰腺导管腺癌患者的最新免疫原性数据。ELI-002是该公司开发的新型癌症免疫疗法,由AMP修饰的mKRAS肽抗原和AMP修饰的CpG佐剂ELI-004组成,旨在靶向KRAS驱动型肿瘤。其中,ELI-002 7P包含七种最常见的mKRAS肽抗原。
在AMPLIFY-7P试验中,ELI-002 7P在99%(89/90)的疗效可评估患者中诱导了mKRAS特异性T细胞应答,展现出强大且一致的免疫激活能力。所有七种mKRAS抗原均引发强效反应,每种突变的应答率均超过80%,88%的患者对其自身肿瘤特异性突变产生免疫应答。此外,86.8%(66/76)的患者产生了细胞毒性mKRAS特异性T细胞应答,分别有75%的患者激活了CD8和CD4 T细胞。值得注意的是,这些免疫反应在多种HLA类型人群中均被观察到,表明ELI-002 7P有望适用于广泛且遗传背景多样的患者群体。
VP-315(ruxotemitide):公布2期临床试验数据
Verrica Pharmaceuticals公司公布了其潜在“first-in-class”在研新药VP-315(ruxotemitide)的2期探索性分析结果。VP-315是一种溶瘤肽类免疫疗法,通过瘤内注射直接诱导免疫原性细胞死亡,从而释放多种肿瘤抗原以激活T细胞应答。该药物基于天然“宿主防御肽”研究开发,旨在为皮肤癌患者提供非手术治疗选择。Verrica拥有开发和商业化VP-315用于某些皮肤肿瘤适应症(包括非转移性黑色素瘤和非转移性默克尔细胞癌)的全球独家许可,并打算最初专注于基底细胞癌和鳞状细胞癌作为开发的主要适应症。
数据显示,VP-315可重塑肿瘤微环境,显著增加细胞毒性T细胞浸润,同时减少免疫抑制性的调节性T细胞。这一免疫机制为此前报道的优异临床疗效提供了理论支持:在基底细胞癌患者中,事后分析的客观缓解率达97%,组织学完全清除率达51%。结合其已证实的良好安全性,VP-315有望成为用于皮肤癌的非手术免疫治疗药物。
Donidalorsen:获EMA推荐上市
EMA宣布,人用药品委员会(CHMP)建议批准Ionis Pharmaceuticals旗下Dawnzera(donidalorsen)用于预防12岁及以上成人和儿童患者的HAE发作。Dawnzera是一款反义寡核苷酸配体偶联(LICA)药物,旨在精确靶向以沉默血浆前激肽释放酶(PKK)的表达,中断导致HAE发作的信号通路。PKK在激活与HAE急性发作相关的炎症介质中起重要作用。
之前所公布的OASIS-HAE临床3期研究结果显示,试验达到主要终点。与安慰剂相比,接受每四周一次(Q4W)Dawnzera皮下注射的患者在24周内月均HAE发作率显著降低81%。当从第二次给药开始评估时,平均发作率降低87%(关键次要终点)。此外,从第二次给药开始测量时,Dawnzera在24周内将中重度HAE发作减少约90%。
这些结果得到了进行中的OASISplus开放标签延长期(OLE)研究的进一步支持。在该研究中,随着时间推移,接受每八周一次(Q8W)Dawnzera治疗患者表现出与Q4W相似的疗效。在OLE研究中,两种给药方案均在一年后实现总平均发作率较基线下降94%。
IBI3016:公布1期临床试验数据
信达生物与圣因生物共同公布了其共同开发的靶向血管紧张素原(AGT)的小干扰核酸(siRNA)药物IBI3016,用于治疗高血压的首次人体临床1期研究的主要结果。IBI3016基于圣因生物专有小核酸药物开发平台GalNAc肝靶向递送技术开发,通过RNAi机制抑制AGT的合成。临床前试验数据显示,IBI3016可抑制AGT在肝脏中的合成,从而可能导致AGT蛋白的持久减少,进一步导致Ang II的减少,最终起到舒张血管、降低血压的效果。
截至2025年7月1日,共40例健康受试者和轻度高血压受试者随机入组5个队列(每个队列IBI3016剂量组与安慰剂组的比例为6:2)。IBI3016单次给药实现了持久强效的AGT水平降低以及初步的血压下降:血清AGT水平得到显著且持久降低,最大降幅超过95%,且在6个月内降幅维持稳定;在3个月时,IBI3016各剂量组均实现了血压下降。IBI3016在6个月内表现出良好的安全性和耐受性,未观察到重度不良事件或严重不良事件,无低血压事件发生。所有不良事件均为轻度至中度且可逆。
RN0361:公布1期临床试验数据
大睿生物公布了其长效靶向ApoC3的siRNA药物RN0361用于治疗血脂异常患者的1期临床研究结果。公开资料显示,ApoC3的升高会促进富甘油三酯脂蛋白的聚集,从而增加急性胰腺炎和心血管疾病的风险,尤以糖尿病患者风险升高为甚。目前的治疗方案往往难以在重症患者中实现持续的控制。
此次公布的结果显示,RN0361呈现出显著的剂量依赖性ApoC3与TG抑制作用,持续至给药后第180天,最高达到ApoC3降低93%,以及甘油三酯降低69%。同时,RN0361还实现了非高密度脂蛋白胆固醇、极低密度脂蛋白胆固醇和残余胆固醇等显著且持久的降低。该产品耐受性良好,未观察到严重不良事件;注射部位反应轻微且可自限;一过性的ALT与AST升高符合GalNAc缀合siRNA药物的典型特征。
Olezarsen:公布3期临床试验数据
Ionis Pharmaceuticals公司宣布,其反义寡核苷酸疗法olezarsen在严重高甘油三酯血症(sHTG)患者中开展的CORE和CORE2关键性3期研究取得了积极结果。Olezarsen旨在抑制机体产生ApoC3。美国FDA于2024年2月授予该疗法孤儿药资格和突破性疗法认定(BTD),并在12月批准其用于作为饮食控制的辅助治疗,以降低家族性乳糜微粒血症综合征成人患者的甘油三酯。
研究显示,olezarsen在6个月时实现了高达72%经安慰剂校正的空腹甘油三酯(TG)平均水平显著降低,且这一降幅在12个月时仍然得以维持。同时,olezarsen还将急性胰腺炎事件风险显著降低了85%,安全性和耐受性表现良好。根据新闻稿,这是首次在研治疗方案可在sHTG患者中显著降低急性胰腺炎事件发生率。
Eloralintide(LY3841136):公布2期临床试验数据
礼来(Eli Lilly and Company)今日宣布,其在研减重多肽疗法eloralintide(LY3841136)在一项2期临床试验中达到主要终点。基于这一结果,礼来计划于下月启动eloralintide用于治疗肥胖的3期临床研究的患者入组。Eloralintide是一款每周一次皮下注射的选择性长效胰淀素受体激动剂,具有良好的耐受性和明确的体重减轻效果。
该试验共纳入263名肥胖或超重且至少伴有一种肥胖相关共病、但未合并2型糖尿病的成年受试者。在第48周时,所有eloralintide治疗组均达到主要终点,平均体重下降幅度从9.5%至20.1%不等,而安慰剂组仅为0.4%,显示出显著的疗效差异。此外,试验同时显示,所有剂量的eloralintide在体重和身体质量指数(BMI)降低等次要终点上均较安慰剂有临床意义的改善。此外,治疗还伴随心血管代谢风险指标的全面改善,包括腰围、血压、血脂、血糖控制以及炎症标志物水平的下降。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..