本期看点
1. 用于治疗肾病的在研药物povetacicept在早期临床研究中表现亮眼,48周数据显示,IgA肾病(IgAN)患者中蛋白尿较基线下降64%,原发性膜性肾病(pMN)患者的蛋白尿较基线下降82%,且两种疾病的估算肾小球滤过率(eGFR)均保持稳定。
2. α/β-IL-2受体偏向性部分激动剂STK-012与标准治疗方案联用,一线治疗PD-L1阴性非鳞状非小细胞肺癌(NSCLC)患者的早期临床试验数据积极,PD-L1阴性患者的客观缓解率(ORR)为53%,与标准治疗方案23-32%的历史缓解率相比具有优势。
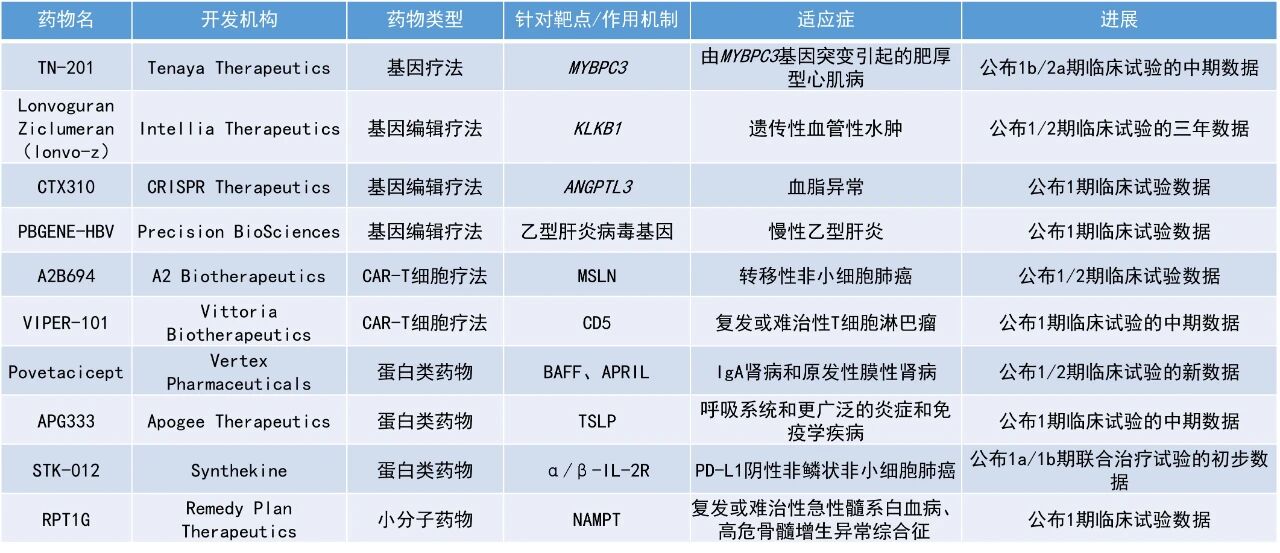
Povetacicept:公布1/2期临床试验的新数据
Vertex Pharmaceuticals公司公布了其在研药物povetacicept(pove)在IgA肾病和原发性膜性肾病中的48周最新数据。Povetacicept是一种高效BAFF(B细胞激活因子)和APRIL(一种增殖诱导配体)的双重拮抗剂,是一款经改造TACI结构域变体的Fc融合体。BAFF与APRIL细胞因子因其在B细胞(特别是抗体分泌细胞)、T细胞和先天免疫细胞中的激活、分化和/或生存所扮演的角色,在多种自身免疫性疾病的发病机制中发挥关键作用。凭借其工程化的TACI结构域,pove在临床前研究中展现出优于其他同类抑制剂的结合亲和力、效力和组织穿透能力。目前,该药已获美国FDA授予pMN适应症的快速通道资格,并计划启动生物制品许可申请的滚动提交以争取加速批准。
在IgAN患者中(n=21),接受每4周一次80 mg剂量pove皮下给药48周后,平均24小时尿蛋白肌酐比(UPCR)较基线下降64%,eGFR保持稳定,90%的患者实现血尿缓解,53%达到临床缓解(定义为UPCR<0.5 g/g、血尿阴性且eGFR较基线降低<25%)。在pMN患者中(n=10),平均24小时UPCR降幅达82%,eGFR同样稳定,40%患者实现完全临床缓解(UPCR<0.5 g/g)。Pove总体安全性和耐受性良好,不良事件多为轻中度,没有发生严重不良事件,安全性特征在两个疾病队列中相似。
STK-012:公布1a/1b期联合治疗试验的初步数据
Synthekine公司公布了其在研药物STK-012与标准治疗方案(pembrolizumab联合化疗)联用,一线治疗PD-L1阴性非鳞状非小细胞肺癌患者的早期临床试验数据。STK-012是一种潜在“first-in-class”的α/β-IL-2受体偏向性部分激动剂,旨在选择性激活抗原特异性T细胞以增强抗肿瘤免疫反应,并避免对其他淋巴细胞的广泛刺激,例如与IL-2毒性相关的自然杀伤(NK)细胞。
此次公布的结果显示,STK-012联合疗法显示出良好的安全性和有效性,无明显IL-2毒性。在25名安全性可评估的受试者中,最常见的治疗相关不良事件(TRAE)是可控制且可逆的恶心、疲劳和皮疹/皮炎。没有受试者因TRAE而停止STK-012治疗。在21例疗效可评估的患者中,STK-012联合标准治疗展现出优于历史对照的抗肿瘤活性:PD-L1<1%患者的整体ORR达53%,远高于既往PD-L1阴性患者接受标准治疗方案23–32%的缓解率。值得注意的是,在10例携带STK11、KEAP1和/或SMARCA4等免疫耐药突变的患者中,ORR达60%,远高于接受标准治疗方案7–33%的历史缓解率。
APG333:公布1期临床试验的中期数据
Apogee Therapeutics公司公布了其在研药物APG333的首次人体1期试验的中期数据。APG333是一种具有延长半衰期的新型单克隆抗体,靶向一种上皮细胞来源的细胞因子TSLP,该细胞因子在促进免疫细胞募集和激活方面发挥着重要作用,已被临床验证为治疗哮喘等炎症性疾病的有效靶点。
此次公布的数据显示,APG333在所有队列中均耐受性良好,剂量高达1000 mg。APG333的半衰期约为55天,单次给药后可持续抑制关键炎症生物标志物长达6个月,显著超出试验预设目标,有望支持每3个月或6个月一次的给药方案。此外,由于TSLP抑制剂可与其他单抗联用以扩大疗效人群,Apogee公司计划将APG333与其另一候选药物APG777联合开发为复方制剂(APG273),用于呼吸道疾病,目标实现每季度一次甚至更少频次的给药。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..