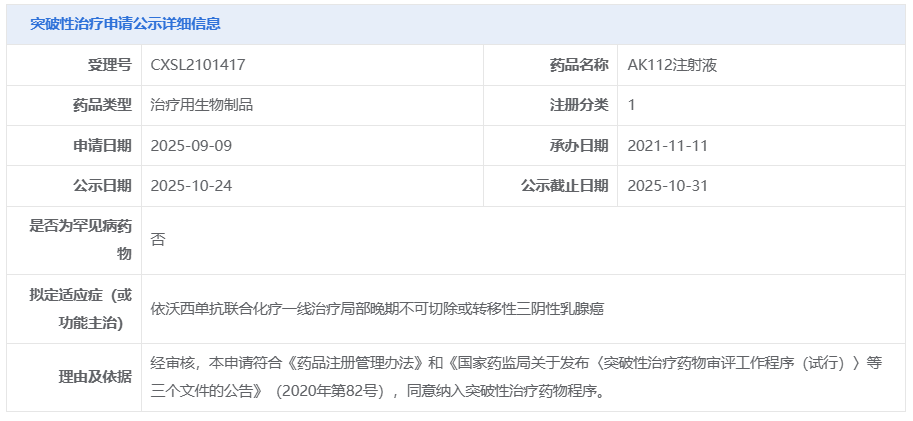
10 月 24 日,CDE 官网显示,康方生物 AK112 注射液(依沃西单抗)又一项申请拟纳入突破性治疗,适应症为依沃西单抗联合化疗一线治疗局部晚期不可切除或转移性三阴性乳腺癌。
截图来源:CDE 官网
依沃西单抗是康方生物自主研发的、全球首创 PD-1/VEGF 双特异性肿瘤免疫治疗药物。此前,该药已有三项申请被 CDE 纳入突破性治疗品种,适应症分别为:一线治疗 PD-L1 表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)、联合化疗治疗经 EGFR-TKI 治疗失败的 EGFR 突变的局部晚期或转移性非鳞 NSCLC、联合多西他赛治疗既往 PD-1/L1 抑制剂和含铂化疗治疗失败的局部晚期或转移性 NSCLC。
本次拟纳入突破性疗法的是一项新适应症:依沃西单抗联合化疗一线治疗局部晚期不可切除或转移性三阴性乳腺癌(TNBC)。2024 年的圣安东尼奥乳腺癌大会 (SABCS) 上,康方生物曾公布了该适应症的 II 期研究结果。
截至 2024 年 5 月 31 日,研究共入组了 30 例局部晚期不可切除或转移性的 TNBC 患者, 80% 的入组患者为 PD-L1 表达阴性人群 (PD-L1 CPS <10),60% 的患者既往接受过紫杉类辅助/新辅助治疗。
中位随访时间为 10.12 个月。29 例患者至少进行了一次基线后肿瘤评估;
研究者评估的 ORR 为 72.4%(21/29),DCR 为 100%(29/29)。PD-L1 CPS≥10 人群中的 ORR 为 83.3%(5/6), PD-L1 CPS<10 人群中的 ORR 为 69.6%(16/23)。
中位 PFS 为 9.3 个月(95% CI:6.24,NE),9 个月 PFS 率为 56.6%(95% CI:32.2,75.1)。在 PD-L1 CPS≥10 的人群中,未达到中位 PFS(95% CI:5.36,NE),9 个月 PFS 率为 60%(95% CI:12.6,88.2)。PD-L1 CPS<10 的人群中,中位 PFS 为 9.3 个月(95% CI:5.55,NE),9 个月 PFS 率为 52.6%(95% CI:22.5,75.8)。
中位 DoR 为 7.49 个月(95% CI:3.91,NE)。在 PD-L1 CPS≥10 的人群中,中位 DoR 尚未达到(95% CI:3.58,NE)。在 PD-L1 CPS<10 的人群中,中位 DoR 为 7.49 个月(95% CI:3.91,NE)。中位 OS 尚未成熟。
安全性数据显示,共计 53.3%(16/30)的患者经历了至少一次 3 级治疗相关不良事件(TRAE),但无一例导致治疗终止或死亡。最常见的 3 级 TRAE(发生率≥10%)包括中性粒细胞计数减少和白细胞计数减少。
综上,研究认为依沃西联合化疗作为 TNBC 的一线治疗,显示出了良好的抗肿瘤活性和可接受的耐受安全性。
目前,康方正在国内开展一项随机、对照、多中心 III 期临床研究(CTR20250033),以评估依沃西联合注射用紫杉醇 (白蛋白结合型) 对比安慰剂联合注射用紫杉醇 (白蛋白结合型) 一线治疗 PD-L1 阴性的局部晚期不可切除或转移性三阴性乳腺癌的效果和安全性。
依沃西单抗已在国内获批两项适应症,分别为:1)联合培美曲塞和卡铂用于经 EGFR-TKI 治疗进展的 EGFR 基因突变阳性的局部晚期或转移性非鳞状 NSCLC 患者的治疗;2)单药用于 PD-L1 阳性的 EGFR 基因突变阴性和 ALK 阴性的局部晚期或转移性 NSCLC 的一线治疗。
今年 7 月,依沃西单抗的第三个适应症上市申请获得 NMPA 受理,联合化疗一线治疗晚期鳞状 NSCLC。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..