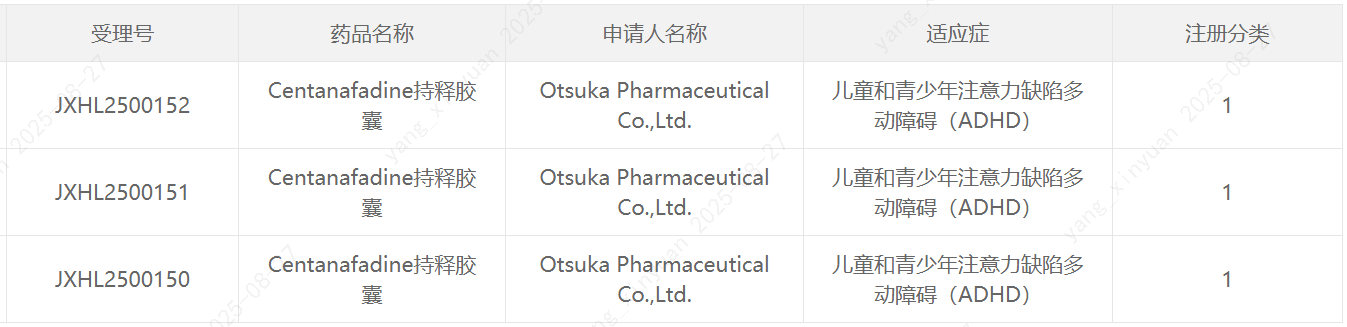
中国国家药监局药品审评中心(CDE)近日最新公示,大冢制药(Otsuka Pharmaceutical)申报的1类新药centanafadine持释胶囊获得临床试验默示许可,拟开发治疗儿童和青少年注意力缺陷多动障碍(ADHD)。公开资料显示,这是一种在研、潜在“first-in-class"的去甲肾上腺素、多巴胺和5-羟色胺再摄取抑制剂(NDSRI)。
注意缺陷多动障碍(ADHD)俗称多动症,是一种慢性大脑疾病,其表现为注意力无法集中,多动,容易冲动。ADHD症状可能在儿童3-6岁时开始出现,可以持续到青少年和成年期。ADHD是儿童期最常见的精神疾病,影响8%至9%的学龄儿童。
Centanafadine是一种去甲肾上腺素、多巴胺和5-羟色胺再摄取抑制剂(NDSRI),正在开发用于治疗儿童、青少年和成人ADHD患者。据文献报道,与现有的ADHD治疗方法相比,centanafadine提供了更广泛的作用机制,它除了影响多巴胺和去甲肾上腺素途径外,还影响血清素能神经传递这种更广泛的机制。
根据大冢制药官网,该产品正在美国和日本开展3期临床研究,针对ADHD适应症。
今年7月,研究人员发表了一项随机、双盲、安慰剂对照试验结果,该研究评估了centanafadine治疗青少年ADHD的疗效、安全性和耐受性。符合ADHD主要诊断标准的青少年(13-17岁,含边界值)被随机分配接受每日一次164.4 mg centanafadine、328.8 mg centanafadine或安慰剂治疗,持续6周。给药无需滴定。主要终点是第6周时ADHD评定量表第5版(ADHD-RS-5)症状总原始评分相对基线的变化。
研究结果显示,在459名参与者中,451人接受了≥1次研究药物治疗,371人完成试验。第6周时,328.8 mg centanafadine组ADHD-RS-5症状总原始评分的改善显著优于安慰剂组;164.4 mg centanafadine组未达到主要终点。328.8 mg centanafadine组在首个基线后时间点(第1周)即与安慰剂组出现分离,且疗效在整个研究期间持续维持。治疗期间出现的不良事件(TEAEs)发生率分别为:164.4 mg组153人中的48人(31.4%)、328.8 mg组151人中的76人(50.3%)、安慰剂组147人中的35人(23.8%)。最常见(任意组≥5%)的TEAEs包括食欲下降、恶心、头痛和皮疹。大多数TEAEs为轻度或中度。
研究人员认为,328.8 mg centanafadine对青少年ADHD治疗有效,两种剂量均总体安全且耐受性良好。
本次该产品在中国获批临床,也意味着该产品即将在中国开展临床研究。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..