本期看点
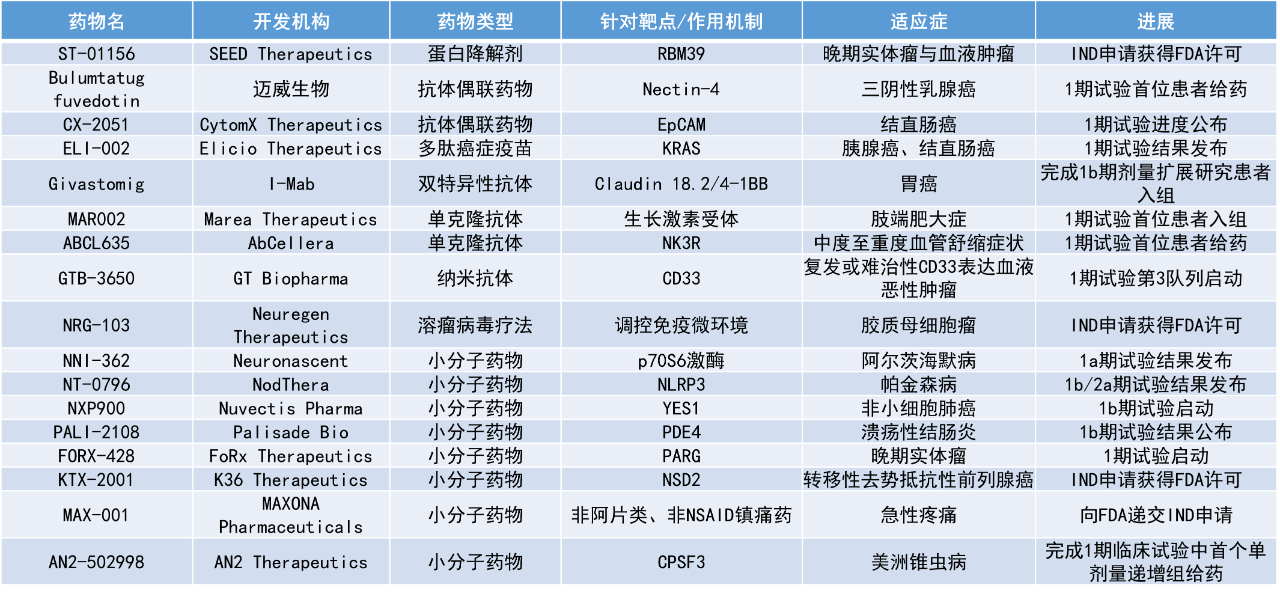
1. Palisade Bio公司公布了其在研潜在“first-in-class”疗法PDE4抑制剂PALI-2108的最新临床数据。分析显示,在1b期溃疡性结肠炎(UC)队列中,PALI-2108实现了100%(5/5)临床应答。
2. Elicio Therapeutics近日宣布,其靶向突变KRAS(mKRAS)的多肽疫苗ELI-002在胰腺癌和结直肠癌患者中展现积极疗效,在T细胞免疫应答超过抗肿瘤疗效阈值的患者中,死亡风险降低77%,复发风险降低88%。
PALI-2108:1b期试验结果公布
Palisade Bio公司公布了其在研潜在“first-in-class”疗法PDE4抑制剂PALI-2108的最新临床数据,包括在中重度溃疡性结肠炎患者中开展的1b期开放标签队列研究积极的主要结果,以及来自1a期多次递增给药(MAD)队列的结肠组织药代动力学(PK)数据。在1b期UC队列中,PALI-2108实现了100%(5/5)临床应答(修订Mayo评分降低30%或3分,且直肠出血评分≤1),平均修订Mayo评分下降62.8%,其中1名患者达到临床缓解。药物在试验中表现出良好的安全性与耐受性,未发生严重不良事件。
研究还显示,PALI-2108具有延长的半衰期及局部生物活性,支持其在溃疡性结肠炎及纤维狭窄型克罗恩病(FSCD)中的每日一次给药方案。在已完成的1a期MAD队列中,结肠组织中药物水平在给药36小时后仍高于目标阈值。公司计划在2026年上半年推进PALI-2108的2期临床研究,并提交IND申请。
ELI-002:1期试验结果发布
Elicio Therapeutics近日宣布,其在《自然》子刊Nature Medicine发表了1期AMPLIFY-201研究的随访数据。该研究评估了靶向mKRAS的多肽疫苗ELI-002在胰腺癌和结直肠癌患者中的疗效。结果显示,在中位随访19.7个月时,T细胞反应水平超过抗肿瘤疗效阈值的受试者在复发或死亡风险方面显著降低。死亡风险降低77%,复发风险降低88%。此外,ELI-002在大多数患者中诱导了mKRAS特异性的CD4+和CD8+T细胞反应,并观察到患者的免疫系统对特异性新抗原产生反应,这些新抗原未包含于原初疫苗的设计当中。
ELI-002是一种在研癌症多肽疫苗,旨在靶向由KRAS基因突变驱动的多种人类癌症。该疫苗由Elicio的Amphiphile(AMP)技术构建,包括AMP修饰的mKRAS肽抗原以及AMP修饰的CpG寡脱氧核苷酸佐剂ELI-004,可作为现成的皮下注射制剂使用。研究结果表明,ELI-002不仅能引发强烈且持久的免疫应答,还显示出通过增强T细胞反应降低肿瘤复发与死亡风险的潜力,为KRAS突变相关癌症的治疗提供了新的方向。
NNI-362:1a期试验结果发布
Neuronascent公司宣布,其研发的口服疗法NNI-362的1a期临床试验结果已发表于Alzheimer’s Research and Therapy期刊。NNI-362是该公司专有主打小分子药物,旨在通过生成新神经元替代慢性与年龄相关的神经退行性疾病中丢失的神经元,从而逆转与衰老相关的疾病。该1a期临床试验的研究对象为健康老年志愿者,主要评估其安全性、药代动力学特征以及阿尔茨海默病进展的血浆生物标志物。
试验结果显示,NNI-362在老年受试者中安全且耐受性良好。在两种最高多剂量组中,NNI-362可显著降低血浆p-tau181水平,与治疗前相比差异具有高度统计学显著性(P<0.0012至P<0.0009),而安慰剂组未观察到显著变化。这一结果为NNI-362在改善年龄相关神经退行性疾病方面的潜力提供了初步临床支持。
NT-0796:1b/2a期试验结果发布
NodThera公司宣布,其口服、可穿越血脑屏障的NLRP3炎性小体抑制剂NT-0796在帕金森病1b/2a期研究中的积极数据已发表于Movement Disorders期刊。数据显示,NT-0796在健康志愿者及帕金森病患者中均表现出良好的安全性与耐受性,具有优异的中枢及全身药代动力学特征,并实现了较高的靶点结合率。
研究结果显示,NLRP3抑制在降低神经炎症方面具有明确作用,显示可减少神经炎症相关生物标志物。在脑脊液(CSF)中,与NLRP3相关的细胞因子IL-1β水平下降,同时相关下游标志物CSF CCL2、IL-6、IL-8和CXCL1亦同步降低;神经炎症CSF标志物sTREM2和神经丝轻链(NfL)水平也持续下降。此外,对于基线存在全身炎症的受试者,NT-0796还能降低多种全身炎症标志物,包括超敏C反应蛋白、纤维蛋白原、IL-6和IL-18。
ST-01156:IND申请获得FDA许可
日前,SEED Therapeutics宣布,美国FDA已批准其在研分子胶药物ST-01156的IND申请。这一批准将支持针对晚期实体瘤和血液恶性肿瘤患者的首次人体1期临床试验的启动,公司将优先聚焦于多种在临床前研究中显示对RBM39依赖性有明确证据的癌症类型。公司预计将在2026年第一季度完成首例患者给药。
SEED自主研发的RITE3平台可通过理性设计筛选出靶向致病蛋白的E3连接酶,并发现具成药性质的分子胶药物,用以治疗多种适应症。ST-01156是SEED的首个进入临床阶段的候选药物,已获FDA授予孤儿药资格和罕见儿科疾病资格,用以治疗尤因肉瘤(Ewing sarcoma)。尤因肉瘤是一种罕见的儿科恶性肿瘤,三十多年来无新疗法获批。
Bulumtatug fuvedotin:1b期试验首位患者给药
迈威生物(Mabwell)公司宣布,其在研抗体偶联药物(ADC)bulumtatug fuvedotin(BFv)在三阴性乳腺癌(TNBC)患者中启动1期临床研究,并已完成首例患者给药。该临床研究旨在评估BFv在既往接受过紫杉类药物及拓扑异构酶抑制剂载荷ADC治疗的TNBC患者中的疗效与安全性。
BFv是一款新型Nectin-4靶向ADC,采用新一代位点特异性偶联技术,由创新抗体、优化连接子及细胞毒载荷MMAE组成,具备良好的肿瘤结合力与靶点特异性。研究显示,BFv具有高组分均一性、可显著降低血浆毒素释放并具有更高效的细胞毒载荷递送能力,从而实现肿瘤内药物浓度的大幅提升。鉴于TNBC患者中Nectin-4高表达,BFv在TNBC的临床研究不设生物标志物筛查要求,有望覆盖更广泛的患者群体,为TNBC患者提供全新的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..