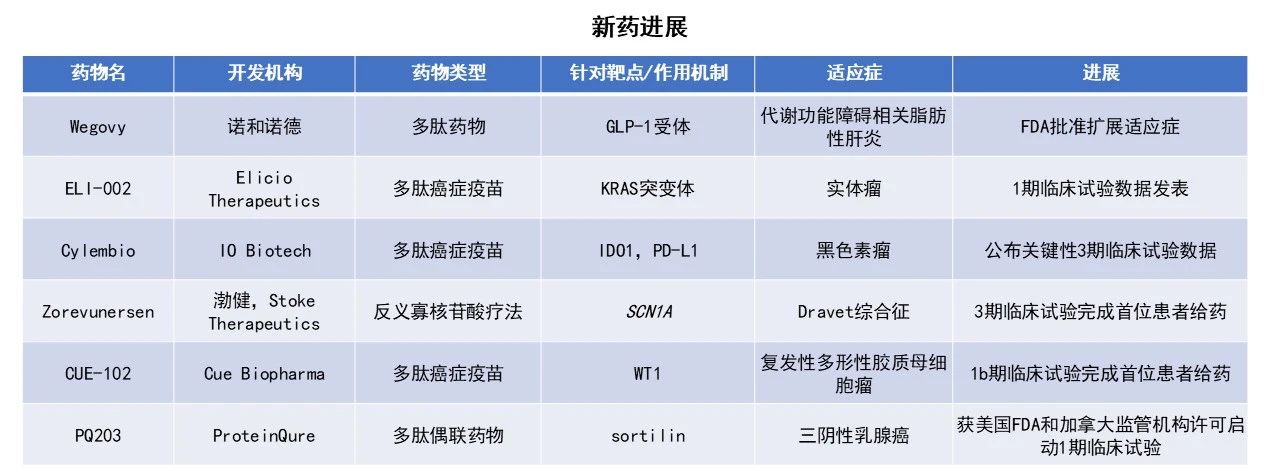
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。诺和诺德(Novo Nordisk)公司的重磅疗法Wegovy(2.4 mg司美格鲁肽)获得美国FDA加速批准,成为首个获批用于治疗代谢功能障碍相关脂肪性肝炎(MASH)的胰高血糖素样肽-1(GLP-1)疗法。Elicio Therapeutics针对KRAS突变体的癌症疫苗ELI-002的1期临床试验结果在Nature Medicine期刊上发表。在T细胞免疫应答超过抗肿瘤疗效阈值的患者中,疾病进展或死亡风险降低88%,死亡风险降低77%。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Wegovy:FDA批准治疗MASH
诺和诺德(Novo Nordisk)宣布,美国FDA已加速批准其重磅疗法Wegovy(2.4 mg司美格鲁肽)的补充新药申请(sNDA),用于联合低热量饮食及增加体育活动,治疗伴有中度至重度肝纤维化(2期或3期)的非肝硬化型MASH成人患者。根据新闻稿,Wegovy为首个获批用于治疗MASH的GLP-1疗法。
此次批准主要基于ESSENCE试验的第一部分结果,该结果已发布于《新英格兰医学杂志》。在第72周时,第一个主要终点数据显示,接受司美格鲁肽治疗的患者中,62.9%达到脂肪性肝炎缓解且肝纤维化未恶化,而安慰剂组为34.3%。两组间应答患者比例的估计差值(EDP)为28.7%(95% CI:21.1-36.2;P<0.001)。第二个主要终点显示,司美格鲁肽治疗组有36.8%的患者肝纤维化得到改善且脂肪性肝炎未恶化,而安慰剂组为22.4%(EDP为14.4%;95% CI:7.5-21.3;P<0.001)。
此外,第72周时的一个次要终点表明,接受司美格鲁肽治疗的患者中有32.7%同时达到脂肪性肝炎缓解及肝纤维化改善,而安慰剂组仅为16.1%(EDP为16.5%;95% CI:10.2-22.8;P<0.001)。
ELI-002:1期临床试验结果发表
Elicio Therapeutics公司日前宣布,在研疗法ELI-002的1期临床试验AMPLIFY-201的随访数据已发表于科学期刊Nature Medicine。数据显示,在T细胞应答超过抗肿瘤疗效阈值的受试者中,其疾病进展或死亡风险显著降低。
这项试验入组了25例处于辅助治疗阶段的实体瘤患者(20例胰腺癌,5例结直肠癌),他们在接受局部治疗后仍存在KRAS突变阳性的微量残留病(MRD)。在84%接受ELI-002治疗的患者中检测到突变KRAS特异性的外周T细胞应答,其中71%患者同时产生CD4阳性和CD8阳性T细胞应答。通过量化循环肿瘤DNA(ctDNA)检测,84%的患者观察到肿瘤生物标志物应答。中位随访时间为19.7个月时,25例患者的中位无复发生存期(RFS)为16.33个月,中位总生存期(OS)为28.94个月。
ELI-002的疗效与其诱导的突变KRAS特异性T细胞应答显著相关,在T细胞应答高于抗肿瘤疗效阈值的17名患者中,11名患者疾病无影像学进展,而应答低于阈值的8名患者均出现影像学进展。高于阈值组患者与低于阈值组相比,疾病进展或死亡风险降低88%,死亡风险降低77%。
ELI-002是一种基于Elicio公司淋巴结靶向两亲性(AMP)技术构建的癌症疫苗,专门靶向由KRAS基因突变驱动的癌症。ELI-002包含两种重要成分:基于AMP技术改造的KRAS突变多肽抗原和AMP改造的寡脱氧核苷酸佐剂ELI-004。
Cylembio:公布关键性3期临床试验结果
IO Biotech公布了在研癌症疫苗Cylembio(imsapepimut与etimupepimut,配合佐剂)关键性3期临床试验的主要结果。该试验在407例不可切除或转移性黑色素瘤患者中,评估Cylembio联合默沙东(MSD)的PD-1抑制剂Keytruda(pembrolizumab)与pembrolizumab单药作为一线治疗的疗效。
分析显示,联合治疗组在无进展生存期(PFS)方面较单药组有所改善,风险比为0.77(95% CI:0.58-1.00),中位PFS分别为19.4个月与11.0个月,但主要终点的统计学显著性(p=0.056)略低于预设阈值(p≤0.045)。在未接受过新辅助/辅助PD-1抑制剂治疗的患者亚组(n=371)中,联合治疗的风险比为0.74(95% CI:0.56-0.98,p=0.037),中位PFS延长至24.8个月,相较对照组的11.0个月有所提升。几乎所有亚组均观察到PFS改善,其中PD-L1阴性肿瘤患者的受益尤为显著(HR=0.54,95% CI:0.35-0.85,p=0.006),联合治疗组中位PFS为16.6个月,对照组为3.0个月。研究还观察到联合治疗组在总生存期(OS)方面呈改善趋势(HR=0.79,95% CI:0.57-1.10),但数据尚未成熟。Cylembio联合pembrolizumab耐受性良好,未发现新的安全性信号。IO Biotech计划于今年秋季与美国FDA会面,讨论该研究数据及潜在上市申请途径。
Cylembio是一款在研的免疫调节、现货型治疗用多肽癌症疫苗,通过激活并扩增针对IDO1阳性和/或PD-L1阳性细胞的T细胞,旨在同时杀灭肿瘤细胞和肿瘤微环境中的免疫抑制细胞。
Zorevunersen:3期临床试验完成首位患者给药
渤健(Biogen)与Stoke Therapeutics公司宣布,全球性3期临床试验EMPEROR的首位患者已接受zorevunersen给药,用于治疗Dravet综合征。Zorevunersen是一种在研反义寡核苷酸(ASO)药物,有望成为首个可改变Dravet综合征疾病进程的治疗方案。
Dravet综合征是一种严重且进展性的遗传性癫痫,其特征是患儿在出生后第一年即出现频繁、长期且难治的癫痫发作,导致发育迟缓和认知障碍。该病通常与编码NaV1.1通道α亚基的SCN1A基因突变有关。当人体中两个SCN1A基因拷贝中的一份因突变而无法产生功能性蛋白时,NaV1.1蛋白水平便会下降,从而引发疾病。
Zorevunersen旨在增强患者体内没有突变的SCN1A等位基因的表达,从而提高NaV1.1蛋白水平。它已经获得美国FDA授予的突破性疗法认定,用于治疗Dravet综合征。渤健与Stoke Therapeutics在今年年初就zorevunersen达成超5亿美元的开发和商业化合作协议。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..