本期看点
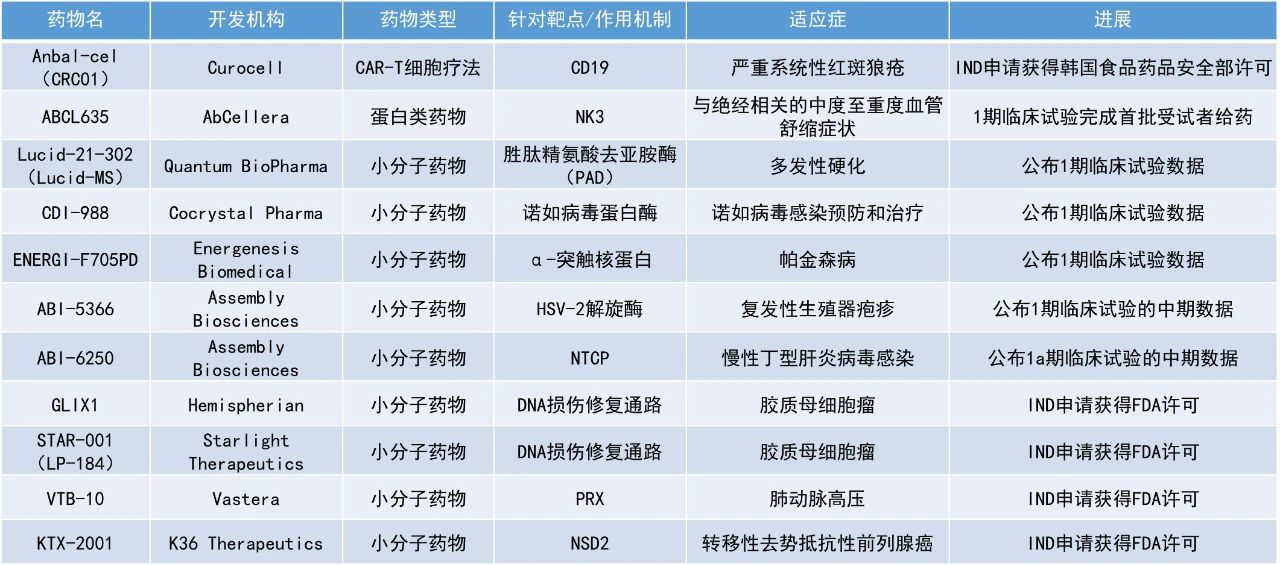
1. Assembly Biosciences公司公布了两款抗病毒疗法的积极早期临床数据,分别用于治疗复发性生殖器疱疹和慢性丁型肝炎病毒(cHDV)感染。
2. 两款针对DNA修复缺陷开发的小分子疗法获美国FDA批准开展临床试验,用于治疗胶质母细胞瘤(GBM)。
ABI-5366:公布1期临床试验的中期数据
Assembly Biosciences公司公布了一种用于治疗复发性生殖器疱疹的长效解旋酶-引物酶抑制剂ABI-5366的1b期临床试验数据。该候选疗法通过靶向病毒解旋酶-引物酶复合体发挥作用。这是一种在HSV-1和HSV-2中都保守的重要病毒酶复合体,并且宿主细胞中没有类似的酶复合体。在短期临床研究中,HSV解旋酶-引物酶抑制剂显示出比核苷类似物更佳的疗效潜力。
在具有统计效力的主要抗病毒终点——HSV-2病毒脱落率方面,接受每周350 mg剂量的队列在29天的评估期内,病毒脱落率较安慰剂组显著降低了94%(p<0.01),显示出强效的抗病毒活性。这一降幅超过了Assembly Biosciences公司为本研究设定的80%-85%的降低目标。在一项次要临床终点——生殖器病变发生率方面,相比于安慰剂组,每周350 mg剂量组的发生率降低94%(p<0.01)。此外,在评估ABI-5366每周口服剂量的前两个队列中,观察到了良好的安全性和耐受性特征。
ABI-6250:公布1a期临床试验的中期数据
Assembly Biosciences公司公布了其正在开展的ABI-6250的1a期临床试验中多个队列的中期数据结果。ABI-6250是该公司研发的一种口服小分子HDV进入抑制剂。截至目前已评估的队列数据显示,口服给药后,ABI-6250的平均半衰期为4天,支持其每日一次的口服给药目标。此外,在单次和多次给药队列中均观察到总血清胆汁酸(TBA)呈剂量依赖性升高。这些生物标志物数据表明,ABI-6250能够强效作用于钠-牛磺胆酸共转运多肽(NTCP,HDV用于感染肝细胞的受体),同时也为后续在cHDV感染患者中评估抗病毒活性的潜在剂量范围提供了依据。
GLIX1:IND申请获得FDA许可
Hemispherian公司宣布,其针对胶质母细胞瘤及其他实体瘤DNA修复缺陷的小分子药物GLIX1的IND申请已获得美国FDA批准。公司将启动GLIX1的首次人体1期临床试验,旨在评估该药物在复发性胶质母细胞瘤患者中的安全性、耐受性、药代动力学及初步疗效。GLIX1基于公司专有的GLIX技术平台开发,能够选择性清除癌细胞,同时最大程度减少对健康组织的影响。在临床前研究中,GLIX1能在经过验证的动物模型中清除肿瘤且副作用有限,具有治疗胶质瘤及其他侵袭性癌症的潜力。
STAR-001(LP-184):IND申请获得FDA许可
Lantern Pharma旗下全资子公司Starlight Therapeutics宣布,其针对胶质母细胞瘤首次进展后患者开展的1b/2a期临床试验已获美国FDA批准。该试验将评估STAR-001(LP-184)联合螺内酯(spironolactone)的疗效。STAR-001是一种可穿透血脑屏障的小分子药物,通过“合成致死”机制靶向DNA损伤修复(DDR)缺陷肿瘤,尤其对高表达PTGR1的肿瘤细胞具有选择性杀伤作用——约60%的GBM细胞具备足够水平的PTGR1来激活STAR-001。而螺内酯作为一种已获批的药物,可通过降解核苷酸切除修复(NER)通路中的关键蛋白ERCC3,诱导NER缺陷(NERD),从而显著增强STAR-001的疗效,使GBM细胞更难以修复药物造成的DNA损伤。这一联合策略具有科学合理性,尤其为在复发阶段已产生耐药的GBM患者带来了新的治疗希望。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..