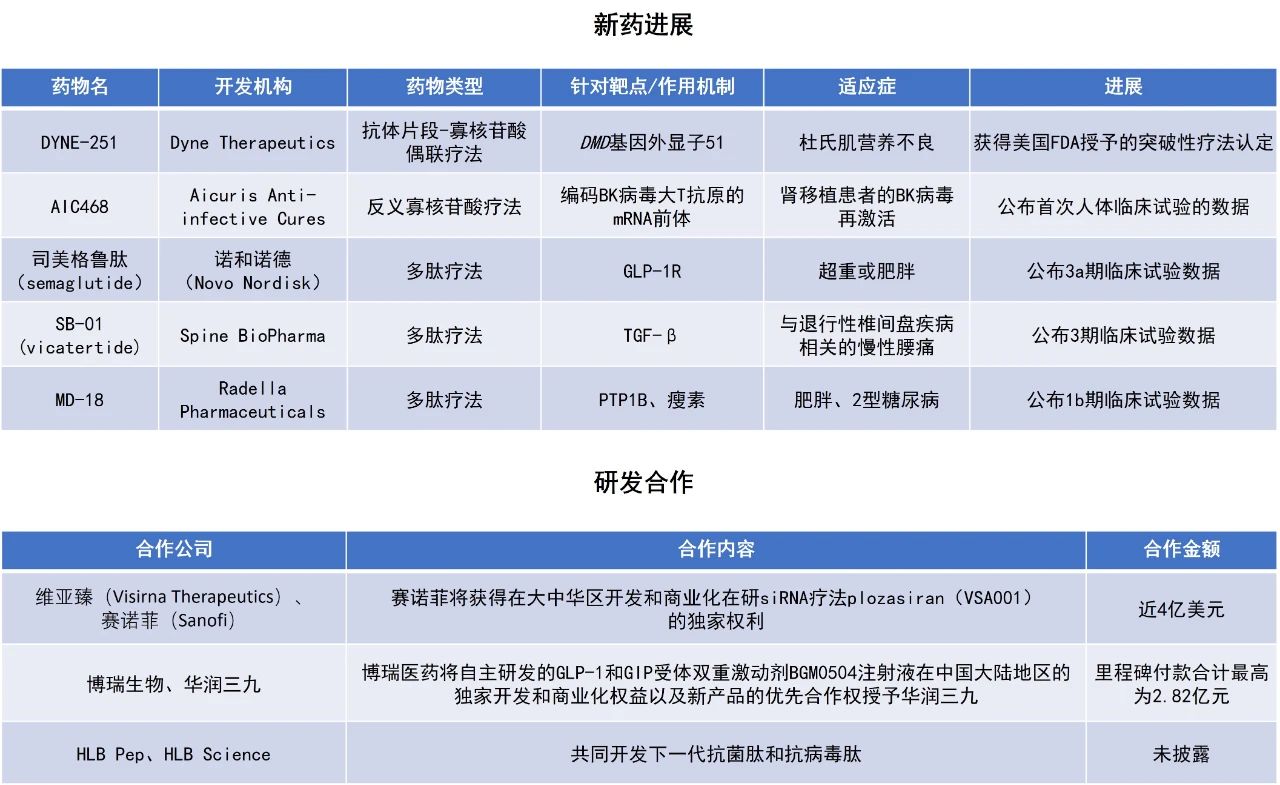
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。Dyne Therapeutics公司用于治疗杜氏肌营养不良(DMD)的在研寡核苷酸疗法DYNE-251获美国FDA授予的突破性疗法认定,该公司预计将于2026年初在美国提交加速批准的生物制品许可申请(BLA)。赛诺菲(Sanofi)与维亚臻(Visirna Therapeutics)签署协议,获得在大中华区开发和商业化在研小干扰RNA(siRNA)疗法plozasiran(VSA001)的独家权利。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
DYNE-251:获得美国FDA授予的突破性疗法认定
Dyne Therapeutics公司宣布,美国FDA已授予在研疗法DYNE-251突破性疗法认定,用于适合外显子51跳跃治疗的DMD患者。该认定的授予基于正在进行的DELIVER临床试验的数据。Dyne已完成DELIVER试验注册性扩展队列的32名患者入组,预计将在2025年底公布该队列数据。该公司预计将于2026年初在美国提交加速批准的生物制品许可申请(BLA)。
DYNE-251由磷酸二氨基甲酰吗啉寡核苷酸(PMO)与靶向转铁蛋白受体1(TfR1)的抗体片段(Fab)偶联而成。TfR1在肌肉组织中高度表达。该疗法旨在实现靶向肌肉组织递送,促进核内外显子跳跃,从而使肌肉细胞生成截短但功能正常的抗肌萎缩蛋白,目标是停止或逆转疾病进展。DYNE-251此前已被FDA授予快速通道和孤儿药资格,以及罕见儿科疾病认定。
赛诺菲近4亿美元助力潜在“first-in-class”疗法开发
Arrowhead Pharmaceuticals宣布,其控股子公司维亚臻与赛诺菲签署协议。根据协议条款,赛诺菲将获得在大中华区开发和商业化在研疗法plozasiran(VSA001)的独家权利。Plozasiran是一款潜在“first-in-class”的siRNA疗法,旨在抑制载脂蛋白C-III(APOC3)的产生,用于治疗家族性乳糜微粒血症综合征(FCS)及重度高甘油三酯血症(SHTG)。根据协议,赛诺菲将向维亚臻支付1.3亿美元的预付款,并在未来根据监管里程碑支付最高2.65亿美元。
维亚臻此前已完成在中国FCS患者中的plozasiran临床3期试验,试验成功达到主要疗效终点及所有关键次要终点。之前公布的试验结果显示,plozasiran在第10个月使患者的中位甘油三酯水平降低高达89%,中位APOC3水平降低高达93%,与安慰剂组相比具有统计学差异。维亚臻已于2025年1月向中国国家药品监督管理局(NMPA)递交新药上市申请,并获得正式受理。此次合作将进一步推动plozasiran在大中华区的临床应用进程,有望为高甘油三酯血症患者带来新的治疗选择。
司美格鲁肽(semaglutide):公布3a期临床试验数据
日前,JAMA Internal Medicine杂志上发表了一项在日本和韩国开展的,使用司美格鲁肽治疗东亚超重或肥胖患者的3a期临床试验的积极结果。该研究共纳入201名成年患者,这些受试者的BMI≥27.0且患有2种或以上相关并发症,或BMI≥35.0且患有1种或以上相关并发症,其中25.4%合并2型糖尿病。受试者被随机分配接受每日一次口服司美格鲁肽50 mg或安慰剂治疗,同时配合生活方式干预,持续68周。
研究结果显示,每日一次口服司美格鲁肽50 mg可使东亚超重或肥胖患者(无论是否合并2型糖尿病)的体重平均降低14.3%,显著优于安慰剂组,同时心脏代谢危险因素也得到改善,且安全性良好。这一发现为东亚人群,尤其是合并2型糖尿病的患者带来新的治疗希望。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..