本期看点
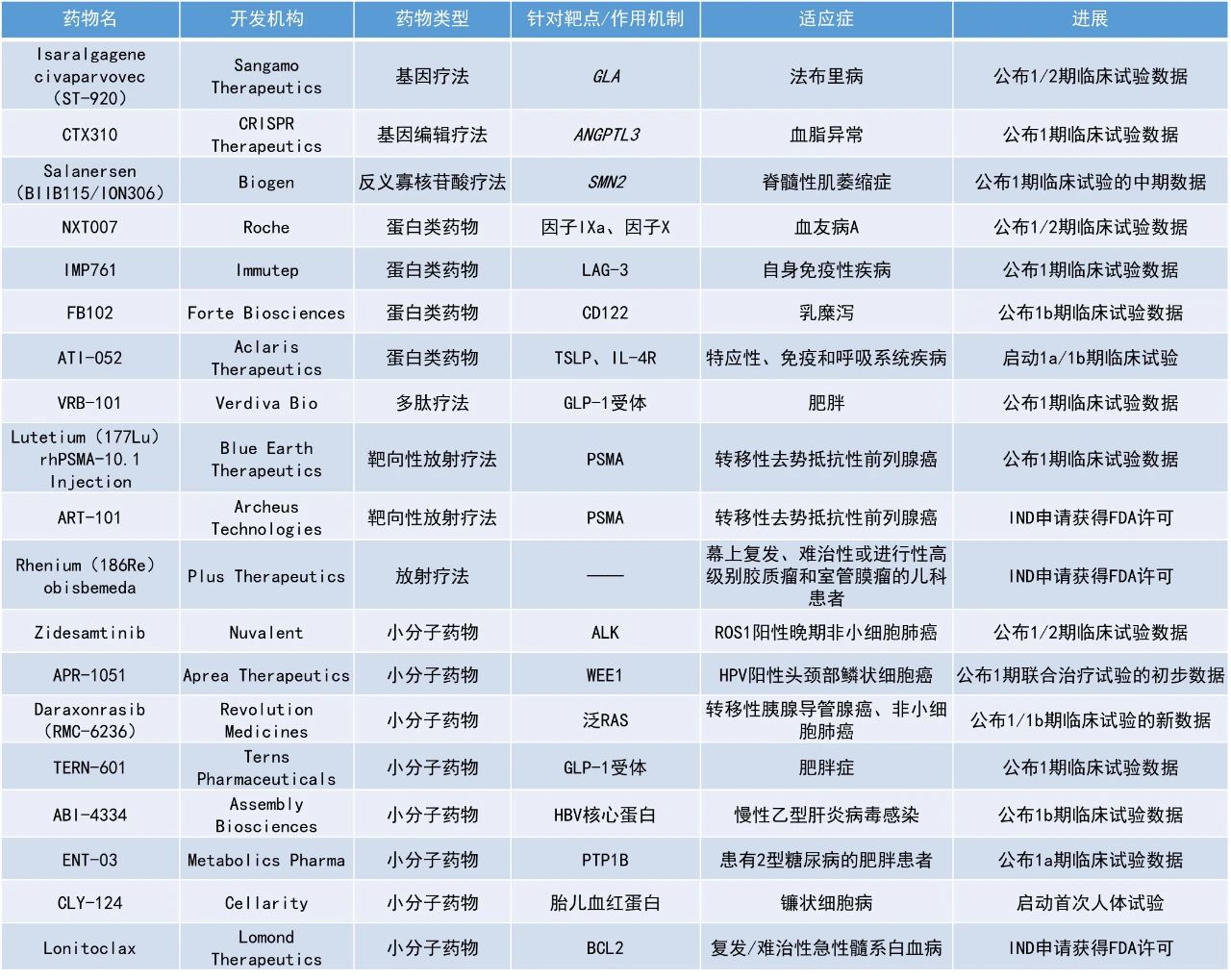
NXT007:公布1/2期临床试验数据
罗氏宣布,其新一代在研双特异性抗体NXT007在治疗血友病A的1/2期临床试验中取得积极数据,将推进至3期临床试验。NXT007由罗氏旗下的Chugai Pharmaceutical公司研发,基于已上市药物Hemlibra的框架优化设计,旨在模拟因子VIII功能,同时延长半衰期,提高疗效和用药便利性。该药通过将凝血因子IXa和X桥接在一起,激活体内自然凝血级联反应,有望使血友病A患者的凝血功能恢复正常,并减少治疗负担。
在这项研究中,30名12至65岁、无因子VIII抑制剂,且既往未接受过Hemlibra治疗的血友病A患者在接受了4至6周的负荷剂量后,在维持期每2至4周皮下注射递增剂量的NXT007。结果显示,高剂量组(B-3和B-4)的患者在整个维持期内均保持止血正常化状态,未出现需治疗的出血事件。安全性方面,NXT007的耐受良好,目前未报告血栓栓塞事件。
Zidesamtinib:公布1/2期临床试验数据
结果显示,在117例曾接受过TKI治疗的ROS1阳性NSCLC患者中(其中50%曾接受过≥2种ROS1 TKI±化疗),由盲态独立中心审查(BICR)评估的客观缓解率(ORR)为44%,初步估计的缓解持续率在12个月时为78%,18个月时为62%。在其中55名曾接受过1种ROS1 TKI(克唑替尼或恩曲替尼)±化疗的患者中,ORR为51%,初步估计的缓解持续率在12和18个月时均为93%。Zidesamtinib还显示出颅内抗肿瘤活性,对携带ROS1 G2032R耐药突变的肿瘤也有作用,整体安全性良好,剂量减少和停药的比例较低,分别为10%和2%。该公司计划于2025年7月启动滚动提交zidesamtinib的新药申请(NDA),目标在2025年第三季度完成。
ABI-4334:公布1b期临床试验数据
Assembly Biosciences公司公布了其在研下一代衣壳组装调节剂ABI-4334用于治疗慢性HBV感染患者的1b期临床试验数据。此前公布的150 mg剂量组的结果显示,ABI-4334显示出很强的抗病毒活性,在28天的治疗中,血浆HBV DNA平均降低了2.9 log IU/mL。此次公布的400 mg剂量组的结果类似于先前的报道,在28天的治疗中,血浆HBV DNA平均降低了3.2 log IU/mL。此外,在400 mg剂量下继续观察到ABI-4334良好的安全性和耐受性,半衰期支持每日一次口服给药。
TERN-601:公布1期临床试验数据
Terns Pharmaceuticals公司公布了其每日一次在研减重疗法TERN-601在肥胖或超重健康成年人中进行的1期试验积极结果。TERN-601是一种口服小分子胰高血糖素样肽-1(GLP-1)受体激动剂,由Terns内部研发。TERN-601通过Terns内部基于结构的药物研发技术设计,采用该公司专有的三维定量构效关系(QSAR)模型所开发。
此次公布的结果显示,TERN-601在治疗肥胖方面表现出显著的疗效和良好的安全性。在28天内,每日一次给药可实现统计学显著且呈剂量依赖性的体重减轻。在最高剂量组中,有67%的患者体重减轻≥5%。其独特的药代动力学特性使其在24小时内维持平稳的血药浓度曲线,有效半衰期为9-10小时,支持每日一次给药。此外,药物在肠道中的暴露量高于血浆,且游离药物比例低,从而在不牺牲耐受性的前提下实现了有意义的体重减轻。安全性方面,未出现因治疗导致的中断、减量或停药,>95%的胃肠道不良事件为轻度,患者的肝酶、生命体征和心电图均无明显变化。
ENT-03:公布1a期临床试验数据
Metabolics Pharma公司公布了其候选药物ENT-03在肥胖和糖尿病患者中开展的1a期临床试验的的初步结果。该研究数据显示,在所有测试剂量下,ENT-03均表现出良好的安全性和耐受性。在较高剂量组中,ENT-03在减轻体重和提高胰岛素敏感性方面呈现出积极趋势。
ENT-03是一种新型中枢神经系统作用的氨基类固醇化合物,具有蛋白酪氨酸磷酸酶1B(PTP1B)抑制活性。它通过作用于大脑中调控能量代谢和血糖平衡的神经回路,达到调节葡萄糖水平、改善胰岛素敏感性并促进体重减轻的效果。临床前研究表明,ENT-03作为单药疗法有效,并且在与GLP-1受体激动剂联合使用时表现出累加效应。此外,ENT-03在停药后仍可维持较长时间的体重降低以及血糖和胰岛素水平的正常化。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..