本期看点
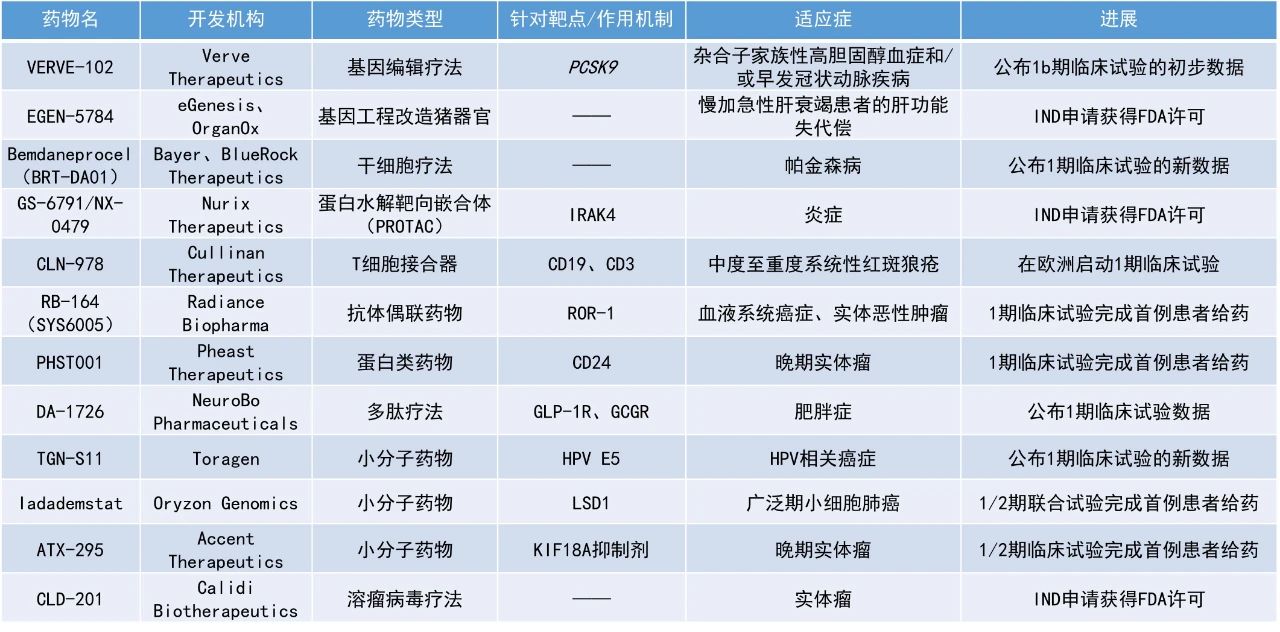
DA-1726:公布1期临床试验数据
MetaVia公司宣布其在研疗法DA-1726的1期临床试验取得了积极结果。DA-1726是一种新型胃泌酸调节素(oxyntomodulin,OXM)类似物,具有GLP-1R和GCGR双激动剂的功能,可通过降低食欲和增加能量消耗来减轻体重。DA-1726被设计为每周皮下注射一次,拟开发用于治疗肥胖和代谢功能障碍相关脂肪性肝炎(MASH)。
此次公布的结果显示,在未进行剂量滴定的情况下,接受32 mg剂量的患者在第26天时最大体重降幅达6.3%,平均降幅为4.3%(p=0.0005),空腹血糖最多降低18 mg/dL,平均降低5.3 mg/dL;第33天时,腰围最多缩小3.9英寸(约9.9厘米),平均缩小1.6英寸(约4.1厘米),显示出胰高血糖素活性的强效信号。目前该公司正在追加试验组以确定最大耐受剂量。
EGEN-5784:IND申请获得FDA许可
eGenesis和OrganOx公司宣布,美国FDA已批准EGEN-5784的IND申请。EGEN-5784是一种适用于人体的基因工程改造猪肝脏,与OrganOx的体外肝脏交叉循环(ELC)系统联用,用于治疗重症监护环境中慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)患者的肝功能失代偿。
2024年11月,OrganOx与eGenesis签署了一项独家临床共同开发协议,以推进这一潜在的救命技术,该技术面向因急性或慢加急性肝衰竭住院的患者,他们现有治疗选择有限,且短期死亡率高达50%。eGenesis的基因工程改造猪肝联合OrganOx的ELC系统,可以支持患者的肝脏功能,促使患者原生肝脏的恢复,或为患者争取足够时间接受肝脏移植。这项1期试验将招募多达20例不适合移植的ACLF及肝性脑病(≤3级)患者。
TGN-S11:公布1期临床试验的新数据
Toragen公司公布了其人乳头瘤病毒(HPV)E5癌基因蛋白小分子抑制剂TGN-S11在HPV相关癌症患者中的1期临床试验数据。研究结果显示,TGN-S11单药或与免疫检查点抑制剂(ICI)帕博利珠单抗(pembrolizumab)联用的安全性良好,没有被认为与TGN-S11相关的严重不良事件。此外,53%接受至少2个月治疗的患者表现出药物活性。基于该结果,公司将推动其第二代E5癌基因蛋白抑制剂TGN-S15进入临床,该候选疗法在临床前研究中显示出更高的疗效以及更少的副作用。
ATX-295:1/2期临床试验完成首例患者给药
Accent Therapeutics公布宣布,其潜在“best-in-class”口服KIF18A抑制剂ATX-295的首次人体1/2期临床试验已完成首例患者给药。此外,ATX-295还获得美国FDA授予的快速通道资格,用于治疗晚期/转移性铂类耐药或难治性卵巢癌成人患者。
ATX-295是有丝分裂驱动蛋白KIF18A的选择性抑制剂,该蛋白在染色体不稳定肿瘤的细胞分裂中起关键作用,但在健康细胞中非必需。此前,Accent公司已证明,其新型、强效、选择性小分子KIF18A抑制剂在临床前模型(包括高级别浆液性卵巢癌和三阴性乳腺癌)中显示出选择性剂量依赖性肿瘤生长抑制作用,支持其进入临床。
Iadademstat:1/2期联合试验完成首例患者给药
Oryzon Genomics公司宣布,其候选疗法iadademstat联合ICI一线治疗广泛期小细胞肺癌(SCLC)的1/2期临床试验已完成首例患者给药。Iadademstat是一种口服小分子,可作为表观遗传酶LSD1的高选择性抑制剂,已在血液肿瘤中展现出强大的作用。除了血液癌,iadademstat联合治疗还在一些实体瘤中展现初步活性。此前,该疗法已在美国获得了用于治疗SCLC的孤儿药资格,在美国和欧盟都获得了治疗急性髓系白血病(AML)的孤儿药资格。
GS-6791/NX-0479:IND申请获得FDA许可
Nurix Therapeutics公司宣布,美国FDA已批准其IRAK4降解剂GS-6791/NX-0479的IND申请,该公司预计将于2025年第二季度启动1期临床试验。GS-6791是一种强效、选择性、口服IRAK4降解剂,靶向IRAK4蛋白激酶的支架和激酶功能,能够阻断toll样受体(TLR)和促炎性IL1细胞因子受体家族(IL1Rs)下游的炎症反应。GS-6791降解IRAK4在治疗类风湿关节炎(RA)和其他炎症性疾病的治疗中具有潜在的应用价值。Nurix公司的合作伙伴吉利德科学(Gilead Sciences)于2023年获得了该项目的独家授权,并负责其临床开发。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..