HIF-2α是一种参与多器官和肿瘤氧感应的促肿瘤转录因子。HIF-2α通路相关研究曾在2019年荣获诺贝尔生理学或医学奖。由于VHL通路的遗传变异,透明细胞肾细胞癌几乎普遍存在HIF-2α调控异常。这会导致假性缺氧状态,并异常增加HIF-2α介导的广泛促癌蛋白表达。
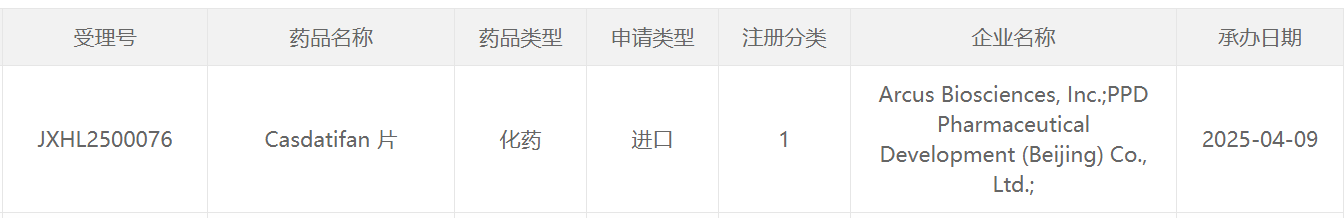
Casdatifan(AB521)是一款在研HIF-2α小分子抑制剂。它通过选择性抑制HIF-2α,旨在阻断多种与肿瘤增殖、生存、耐药和血管生成相关的通路,从而导致癌细胞死亡。
ARC-20是一项1/1b期剂量递增和扩展研究,研究评估了在转移性透明细胞肾细胞癌(ccRCC)患者中casdatifan的疗效,这些患者中的大多数在至少接受过两种前期治疗后病情进展。今年2月公布的新数据包括50mg每日两次组,以及50mg每日一次和100mg每日一次组的数据。
数据显示,在接受每日两次casdatifan(50 mg)治疗的患者队列中,无进展生存期(PFS)达到9.7个月,其它剂量组的PFS尚未达到。在所有3个剂量组中,casdatifan的疾病控制率均超过80%。截至2025年1月3日,大多数患者(81%~87%)病情得到控制,表现为部分缓解或疾病稳定,而且大多数患者仍在接受治疗。中位缓解持续时间尚未达到,所有三个组中26例应答患者中除两例外均仍在接受治疗。Arcus公司新闻稿表示,与迄今为止发表的HIF-2α抑制剂研究数据相比,casdatifan在总缓解率和中位PFS方面均显示出改善。此外,casdatifan在所有剂量下均具有可接受且可控的安全性。
HIF-2目前已经成为抗癌疗法开发的重要靶点。在全球范围内,默沙东(MSD)HIF-2α抑制剂贝组替凡片(belzutifan)是美国FDA加速批准的首个HIF-2α抑制剂,已经获批晚期肾细胞癌、VHL疾病相关癌症等适应症,该药还于2024年底在中国获批上市,用于治疗VHL病相关肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)。除了贝组替凡片,全球范围内还有多款HIF-2α抑制剂处于积极的临床开发阶段,包括:翰森制药引进的HS-10516(NKT2152)胶囊、贝达药业在研的BPI-452080片、诺华(Novartis)在研的DFF332片等。
期待这些在研新药后续临床开发顺利进行,早日为更多患者带来新的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..