雌激素受体(ER)信号在乳腺癌发生中的作用已被证实。几十年来,内分泌治疗一直是ER阳性晚期或转移性乳腺癌患者的主要治疗方法。芳香化酶抑制剂、选择性雌激素受体调节剂和选择性ER降解剂(SERD)成为ER阳性乳腺癌患者治疗策略的组成部分。然而由于耐药性等的存在,这一患者群体仍然存在未被满足的临床需求。E3连接酶嵌合降解代表了一项技术进步,有潜力诱导有效和更深的ER降解。
AC699正是一款靶向ERα的新型嵌合降解物。它通过将ER配体有效地连接到E3连接酶招募配体上,使ERα靠近E3连接酶,导致ERα的泛素化和随后的降解。嵌合ER降解物具有降解ER蛋白的独特优势,而避免了激活ER信号的风险。此外,这些分子不会与目标蛋白一起降解,从而允许它们在细胞内有效地循环利用。这种直接机制使得嵌合ER降解物能够实现更强的ER降解,并且特异性更高。
2024年8月,冰洲石生物宣布AC699获FDA授予快速通道资格,用于ER阳性、HER2阴性、ESR1突变的晚期或转移性乳腺癌,这些患者在至少1种内分泌基础治疗中或之后疾病进展。
在2024年的美国临床肿瘤学会(ASCO)大会上,研究人员公布了AC699治疗晚期或转移性乳腺癌的1期临床研究结果。截至数据截止,共有22名患者在3个剂量组(100,200和300mg)中接受了AC699治疗。患者的中位年龄为61岁,既往治疗的中位线为5(范围2-10)。先前的治疗包括CDK4/6抑制剂(100%)、芳香化酶抑制剂(91%)、氟维司汀(82%)、新型口服SERD或共价拮抗剂(SERCA)(23%)和ER嵌合降解剂(14%)。没有剂量限制性毒性、剂量减少或治疗相关不良反应的停药,也没有达到最大耐受剂量。
有效性方面,在12例可评估患者中,4例(33%)获得部分缓解(PR),包括病情稳定≥24周患者在内的临床获益率(CBR)为42%(5/12)。在确认ESR1突变的可评估患者亚组中,ORR为67% (4/6),CBR为83%(5/6),中位治疗时间为168天(范围56-336),7例患者中有4例仍接受AC699治疗。研究人员认为,AC699的安全性、耐受性和抗肿瘤活性良好,剂量高达300mg,可每日一次口服。
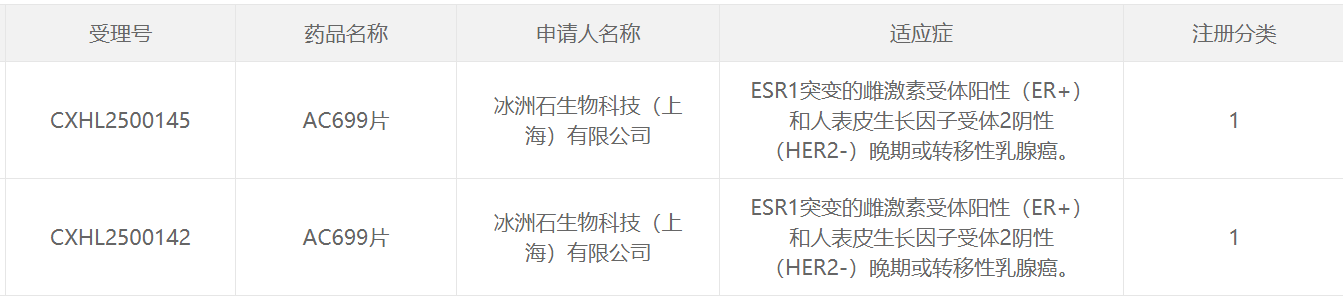
本次这款创新降解剂在中国获批临床,意味着该产品即将在中国启动临床研究。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Apr 8,2025, From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]Accutar Biotechnology Receives FDA Fast Track Designation for AC699 in ER+ / HER2- Breast Cancer. Retrieved Aug 14, 2024 from https://www.accutarbio.com/accutar-biotechnology-receives-fda-fast-track-designation-for-ac699-in-er-her2-breast-cancer/
[3]Preliminary results from a phase 1 study of AC699, an orally bioavailable chimeric estrogen receptor degrader, in patients with advanced or metastatic breast cancer. Retrieved May 29, 2024 from https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.3074
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..