2025 年 Q2,哪些重磅抗肿瘤新药会在国内获批上市?
根据 Insight 数据库「中国上市策略& 时长预测」模块,2025 年 Q2 预计将有11 款抗肿瘤新药有望首次在国内获批。
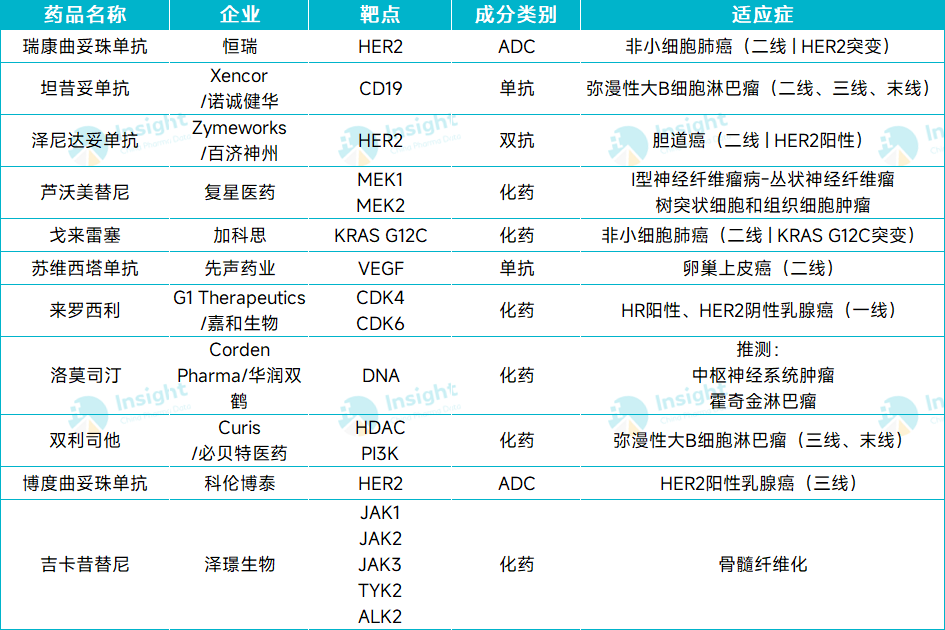
截图来源:Insight 数据库整理
HER2 ADC
瑞康曲妥珠单抗由曲妥珠单抗、可裂解多肽连接子、以及 Exatecan 衍生物 SHR9265 组成,可特异性结合肿瘤细胞表面上的 HER2,通过组织蛋白酶水解释放游离毒素,从而抑制 DNA 拓扑异构酶 I 的活性,最终诱导肿瘤细胞的凋亡。
2025 年 2 月,瑞康曲妥珠单抗单药用于既往经治 HER2 突变晚期 NSCLC 患者的 II 期 HORIZON-Lung 临床研究的主要结果发表于《The Lancet Oncology》。结果显示,该药是首个在 HER2 突变 NSCLC 人群中证实有效性和安全性的国产 ADC,有望为该人群提供更优的治疗选择。
瑞康曲妥珠单抗目前已开展多项 I-III 期临床研究,涵盖 HER2 表达或突变的晚期胃癌或胃食管结合部腺癌、结直肠癌、晚期非小细胞肺癌、早期或晚期乳腺癌、胆道癌、妇科恶性肿瘤等。
CD19 单抗
2024 年 6 月 21 日,诺诚健华 CD19 单抗坦昔妥单抗(Tafasitamab)联合来那度胺治疗不适合自体干细胞移植条件的复发/难治弥漫性大 B 细胞淋巴瘤(DLBCL)成人患者的上市许可申请获受理,并纳入优先审评。
坦昔妥单抗是一款靶向 CD19 的 Fc 结构域优化的人源化单克隆抗体,可通过细胞凋亡和免疫效应机制介导 B 细胞肿瘤的裂解。坦昔妥单抗的权益是几经周转:
最初由 MorphoSys 公司在 2010 年从 Xencor 公司获得全球独家开发和商业化权利。
2020 年 1 月,MorphoSys 和 Incyte 签署了在全球开发和商业化坦昔妥单抗的合作及许可协议,并在 2024 年 2 月达成新协议,授予 Incyte 全球范围内独家开发和商业化权利。
HER2 双抗
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..