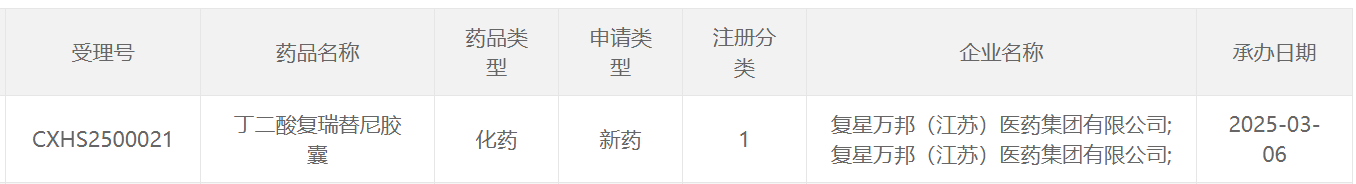
 图片来源:CDE官网
图片来源:CDE官网
肺癌患者中约80%~85%为非小细胞肺癌(NSCLC)。根据文献数据,中国NSCLC患者中约5.6%呈现间变性淋巴瘤激酶(ALK)基因突变。目前多项研究表明了二代或三代ALK抑制剂的疗效,ALK阳性患者治疗进入“慢病化”管理模式。但耐药、疾病复发和中枢神经系统进展、以及各种安全性等问题仍然存在。
REMARK研究是一项开放标签、随机、3期临床研究,纳入了既往未经治疗的ALK阳性晚期NSCLC患者。患者根据基线ECOG评分(0/1 vs 2)和是否发生CNS转移进行分层分析,并按1:1比例随机分为接受复瑞替尼治疗(160mg,每日一次)或另一款ROS1酪氨酸激酶抑制剂治疗(250mg,每日两次,以下称“对照药”)。研究主要终点为由独立评审委员会(IRC)评估的无进展生存期(PFS)。
根据复星医药此前公布的研究结果,从2020年12月至2022年3月,该研究共招募275例患者,其中139例接受复瑞替尼治疗,136例接受对照药治疗。截至2024年3月,中位随访时间为16.7个月。研究发现:
复瑞替尼治疗组的PFS相较于对照药治疗组具有显著改善,对照药治疗组的中位PFS为13.93个月,而复瑞替尼治疗组尚未达到。
此外,相比于对照药,复瑞替尼显著降低CNS进展风险。对照药治疗组中位至CNS进展时间(CNS-TTP)为19.32个月,而复瑞替尼组尚未达到。另外,复瑞替尼有改善总生存期(OS)的趋势。
同时,研究结果显示复瑞替尼治疗组的客观应答率(ORR)达到92.8%,相较于对照药治疗组提高12%(P=0.0035);且对于基线脑转移的患者,复瑞替尼治疗组的颅内ORR可达到100%,而对照药治疗组为50%。
安全性方面,复瑞替尼治疗组患者3/4级治疗相关不良事件(TRAEs)的发生率为37.7%,对照药治疗组为55.6%。复瑞替尼治疗后最常见的3/4级TRAEs为高血糖、高血压和QT间期延长。复瑞替尼治疗组未观察到间质性肺病或视力下降。两组患者治疗后均未报告致死性TRAE。
研究人员认为,该研究结果表明复瑞替尼整体疗效良好,相比于对照药治疗可使PFS显著改善,使CNS进展风险降低,且其安全性可控,治疗后未出现新的安全性信号。复瑞替尼的出现有望突破目前ALK阳性NSCLC治疗所面临的临床困难,为NSCLC患者带来新的治疗选择。
本次复瑞替尼在中国的上市申请获得受理,意味着该产品距离造福患者再进一步。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..