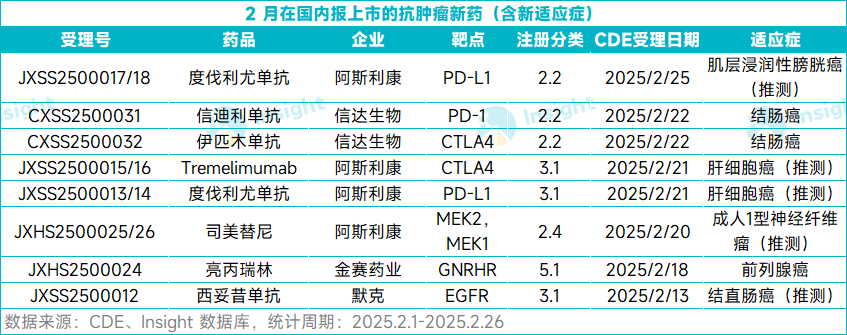
根据 Insight 数据库,今年 2 月份(2.1- 2.26 ),共计有 19 款新药向 CDE 递交了上市申请(含新适应症),包括 12 款进口药,7 款国产药。
药物类型上,化药有 9 款,生物药有 10 款。疾病领域来看,抗癌药依然不少,有 8 款。本文将节选其中部分抗肿瘤新药信息做介绍,仅供参阅。
信达:信迪利单抗+伊匹木单抗
首个国产 PD-1 + CTLA-4 联合疗法报上市
2 月 22 日,信达生物「信迪利单抗+伊匹木单抗」的联合疗法上市申请获得 CDE 受理,用于可切除的微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)结肠癌患者的新辅助治疗。该申请已被纳入优先审评。

截图来源:CDE 官网
信迪利单抗是一种 PD-1 抑制剂,已在国内获批 8 项适应症,涵盖经典型霍奇金淋巴瘤、非鳞状非小细胞肺癌、鳞状非小细胞肺癌、肝细胞癌、食管鳞癌、胃及胃食管交界处腺癌、子宫内膜癌多个癌种。伊匹木单抗(IBI310)是信达开发的一种 CTLA-4 单抗,也是首个申报上市的国产 CTLA-4 单抗。
本次上市申请是基于 III 期注册研究 NeoShot(NCT05890742)的结果。该研究旨在评估伊匹木单抗+信迪利单抗新辅助治疗可切除的 MSI-H/dMMR 结肠癌的有效性和安全性。研究的主要终点为病理完全缓解率(pCR)和无事件生存期(EFS)。期中分析结果显示,经独立数据监查委员会(iDMC)评估,研究达到了预设的主要研究终点。
虽然 Ⅲ 期具体数据尚未披露,但在伊匹木单抗联合信迪利单抗新辅助治疗 MSI-H/dMMR 结肠癌的 Ib 期研究中,已看到了优秀的结果。根据 2024 年 ASCO 年会上披露的数据,在符合研究方案分析 (PP) 集中,联合疗法组的 pCR 率为 80.0%,显著高于信迪利单抗单药组(47.7%)。
Insight 数据库显示,在 PD-1 + CTLA-4 联合疗法开发上,此前全球仅有 BMS 的纳武利尤单抗+伊匹木单抗、阿斯利康的度伐利尤单抗+替西木单抗上市,信达的信迪利单抗+伊匹木单抗是首个报上市的国产 PD-1 + CTLA-4 联合疗法。
阿斯利康:替西木单抗+度伐利尤单抗
递交第 2 项 NDA
2 月 21 日,阿斯利康申报的 Tremelimumab(替西木单抗)、度伐利尤单抗上市申请获得受理。根据两款药物的研究进度,推测本次申请适应症可能为两药联合用于晚期肝细胞癌一线治疗。
度伐利尤单抗是一种 PD-L1 单抗,此前已在国内获批 3 项适应症,涵盖非小细胞肺癌(NSCLC) 、广泛期小细胞肺癌、胆道癌。替西木单抗是一种 CTLA-4 单抗,尚未在国内获批。
在海外,替西木单抗已获批两项适应症,均是与度伐利尤单抗联合用药,用于 NSCLC 一线治疗、肝细胞癌一线治疗。在国内,阿斯利康也开展了替西木单抗的多个 Ⅲ 期,用药方案都是与度伐利尤单抗联合治疗,适应症包括肝细胞癌(一线)、NSCLC(一线)、小细胞肺癌(一线)、小细胞肺癌(维持/巩固治疗)、尿路上皮癌/膀胱癌(一线)。
2024 年 10 月,阿斯利康已向 CDE 递交了度伐利尤单抗+替西木单抗联合疗法的首个上市申请,本次递交的是该联合疗法的新适应症。根据海外获批信息和国内临床研究进展推测,这两次申请的适应症大概率分别为 NSCLC 一线治疗、肝细胞癌一线治疗。
阿斯利康/默沙东:司美替尼
成人 NF1 患者的希望
2 月 20 日,阿斯利康递交的 MEK 抑制剂司美替尼新适应症上市申请获得受理。根据该药的临床研究进度推测,本次申请的适应症可能为治疗存在症状、不能手术丛状神经纤维瘤的成人 1 型神经纤维瘤(NF1)。
司美替尼由阿斯利康和默沙东共同开发,此前已获 NMPA 批准上市,用于治疗 3 岁及 3 岁以上伴有症状、无法手术的丛状神经纤维瘤的 NF1 儿童患者。国内,阿斯利康还开展了一项国际多中心(含中国)III 期研究(KOMET,CTR20220093),以评估司美替尼治疗存在症状、不能手术丛状神经纤维瘤的成人 NF1 受试者的有效性和安全性。
去年 11 月,阿斯利康和默沙东曾公布了司美替尼针对成人 NF1 的 Ⅲ 期 KOMET 试验的积极顶线结果。数据显示,与安慰剂相比,司美替尼在这些成人患者中表现出 ORR 的统计学显著和临床意义的改善。安全性方面,司美替尼与儿童和青少年临床试验中观察到的安全性一致,没有发现新的安全信号。
Insight 数据库显示,国内目前共有三款 MEK 抑制剂获批上市,分别为诺华的曲美替尼、阿斯利康/默沙东的司美替尼、科州制药的妥拉美替尼。但在 NF1 适应症上,目前仅有司美替尼获批。
不过,复星医药已经于 2024 年 6 月在国内递交了其 MEK 抑制剂复迈替尼用于治疗 2 岁及 2 岁以上儿童 NF1 相关的丛状神经纤维瘤的上市申请。该申请已被纳入优先审评,预测有望在今年 Q2 获批,成为首个拿下 NF1 适应症的国产 MEK 抑制剂。
金赛药业:亮丙瑞林注射乳剂
半年一次的前列腺癌新药
2 月 18 日,金赛药业递交的亮丙瑞林注射乳剂上市申请获得 CDE 受理,用于晚期前列腺癌的雄激素去势治疗(ADT)。该药是一种促性腺激素释放激素激动剂(GnRHa)类长效制剂,采用皮下注射,给药频率长达半年一次。
亮丙瑞林注射乳剂是金赛药业与逸达生物合作的一款长效制剂,金赛药业拥有该产品的中国区权益。针对晚期前列腺癌患者,亮丙瑞林注射乳剂已在两项关键临床研究中达到了预设的疗效终点,且安全性良好。此前,该药已在美国、加拿大、欧盟和中国台湾地区获批上市(商品名为 CAMCEVI)。
根据金赛药业公开资料,亮丙瑞林注射乳剂采用即用型单支预充式注射器包装,产品规格为 42 mg(以亮丙瑞林计,相当于 48 mg 甲磺酸亮丙瑞林),使用前无需复溶,非常便捷。
除了上述抗肿瘤新药,本月还有多款其它新药在国内递交了 首个NDA(见下表),限于篇幅,本文不再一一介绍。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..