2月12日,中国国家药监局药品审评中心(CDE)官网公示显示,再鼎医药申报的瑞普替尼胶囊拟纳入优先审评,适用于NTRK融合基因阳性实体瘤成人患者。公开资料显示,瑞普替尼是靶向作用于ROS1致癌因子的新一代酪氨酸激酶抑制剂(TKI),再鼎医药拥有该产品在大中华区的独家开发及商业化权。
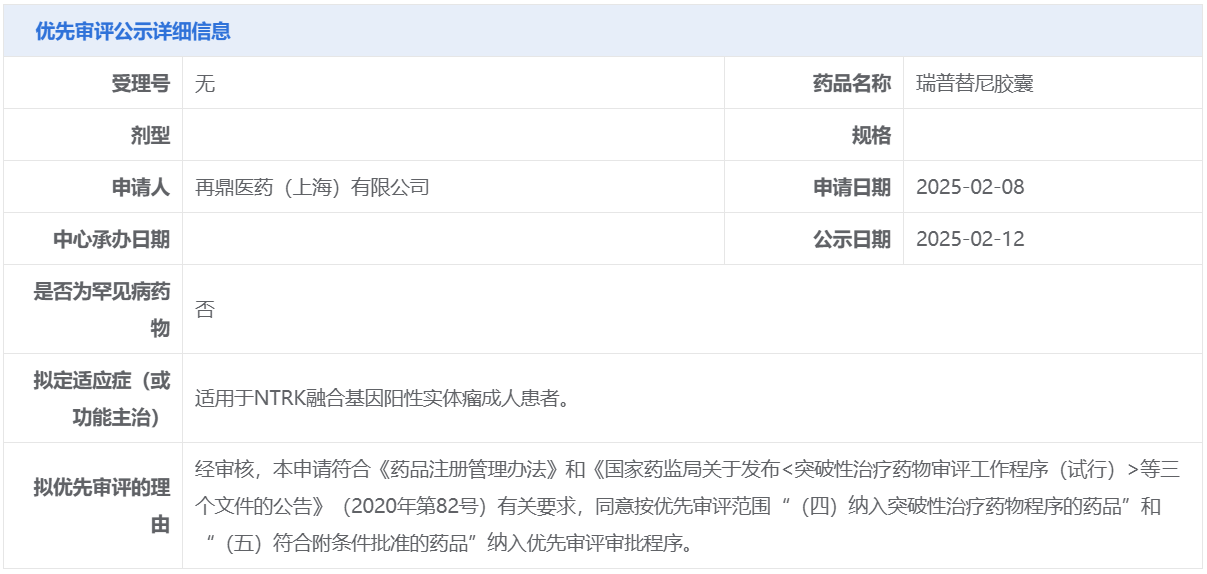
截图来源:CDE官网
神经营养酪氨酸受体激酶(NTRK)是一类参与神经发育的受体。NTRK基因融合是当含有NTRK基因的染色体片段断裂并与另一条染色体上的基因结合时发生的变异。这类融合导致异常蛋白质的产生,从而可能导致癌细胞生长。
瑞普替尼(repotrectinib)最初由Turning Point公司(现已被百时美施贵宝收购)开发,是一款ROS1和NTRK靶向抑制剂。它具有独特的结构,与靶点蛋白的结合位点位于“ATP口袋”内,并且不受多种耐药性突变的影响。因此,它能够克服多种对其它TKI产生抗性的基因突变,杀死携带ROS1或NTRK基因融合的多种肿瘤细胞,有潜力治疗ROS1阳性的NSCLC,以及ROS1、NTRK和ALK阳性的实体瘤。
瑞普替尼于2023年11月获FDA批准用于局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)成人患者的治疗,并于2024年5月获中国NMPA批准上市,用于ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。
2024年6月,美国FDA加速批准瑞普替尼用于治疗NTRK基因融合阳性实体瘤成人患者和12岁及以上儿童患者。此次获批是基于1/2期TRIDENT-1研究的结果,该研究评估了瑞普替尼在NTRK阳性成人实体瘤患者中的疗效。
根据再鼎医药此前新闻稿介绍,TRIDENT-1研究纳入了40名TKI初治患者和48名接受过TKI治疗的患者,这些受试者患有NTRK阳性的局部晚期或转移性实体瘤,涵盖了15种不同类型的癌症。再鼎医药参与了TRIDENT-1研究并负责该研究在大中华区的执行。
TRIDENT-1研究结果显示,在TKI初治患者中,中位随访时间为17.8个月,客观缓解率(cORR)为58%,其中43%的患者达到部分缓解(PR),15%的患者达到完全缓解(CR)。在这些达到缓解的患者中,83%的患者在接受瑞普替尼治疗一年后仍持续缓解,中位持续缓解时间(mDOR)尚未达到。在接受过TKI治疗的患者中,中位随访时间为20.1个月,cORR为50%,其中50%的患者达到PR,没有患者达到CR。此外,42%达成缓解的患者在接受瑞普替尼治疗一年后仍持续缓解,mDOR为9.9个月。在基线时有可评估中枢神经系统(CNS)转移的患者中,2名TKI初治患者和3名接受过TKI治疗的患者均观察到颅内缓解。
本次瑞普替尼针对NTRK融合基因阳性实体瘤适应证在中国拟纳入优先审评,意味着其有望在中国加速获批。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..