1. 用于治疗溃疡性结肠炎(UC)的口服抗体疗法达到1b期临床试验的主要目标,并在多个临床终点方面展现良好的活性。
2. 中枢神经系统(CNS)渗透性TYK2抑制剂A-005取得积极的1期临床试验结果,具有良好的耐受性,并能穿越血脑屏障。
3. 用于治疗慢性乙型肝炎病毒(HBV)感染的下一代衣壳组装调节剂(CAM)ABI-4334在1b期临床试验中展现强力的抗病毒活性,28天使患者血浆HBV DNA平均降低了2.9 log IU/mL。
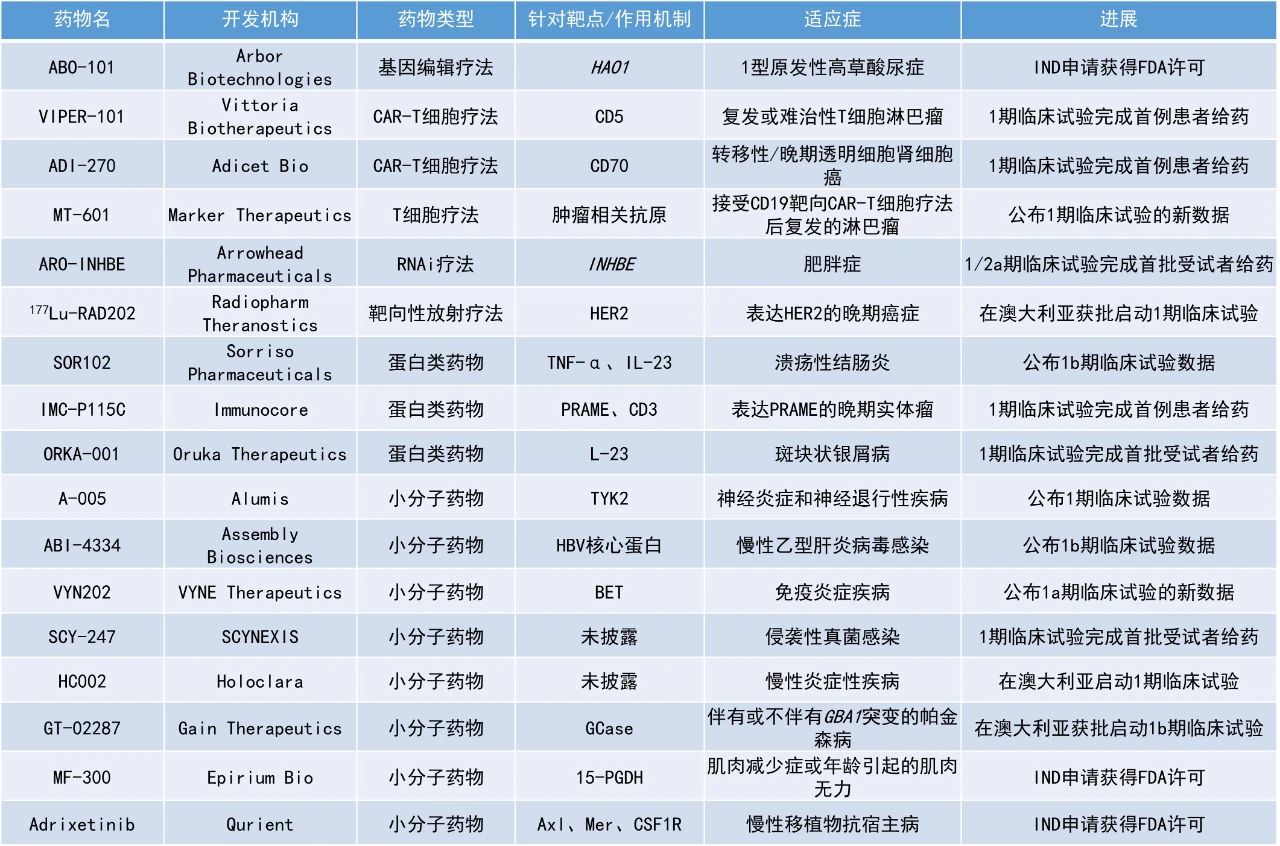
Sorriso Pharmaceuticals公司公布了其针对溃疡性结肠炎患者的口服TNFα和IL-23双效生物制品SOR102的积极1b期临床试验结果。SOR102通过在发炎组织内部提供局部组合疗法,同时尽量减少全身暴露,有望通过同时阻断炎症性肠病的不同机制来提高疗效。此次公布的结果显示,该研究达到了主要目标,显示出良好的安全性和耐受性。此外,关键的探索性疗效终点结果显示,SOR102在多个临床终点方面具有良好的活性。具体表现为,在完成研究的患者中,高剂量SOR102组患者在多个临床终点上与安慰剂组患者相比达到了统计学上的显著差异,包括Mayo评分临床缓解、改良Mayo评分临床缓解、症状缓解,以及Mayo评分、改良Mayo评分和UC-100评分与基线相比的平均下降值。新闻稿指出,该研究结果首次成功证明了口服抗体能够产生临床疗效。Alumis公司公布了其强效、选择性、CNS渗透性TYK2抑制剂A-005的1期临床试验的积极数据。新闻稿指出,A-005是首个公开的TYK2变构抑制剂。该候选疗法旨在实现最大的TYK2抑制效果,并能够穿越血脑屏障,在CNS内部和外周进行局部治疗,支持其在多个TYK2介导适应症中的潜力。该候选疗法正在开发用于治疗神经炎症和神经退行性疾病,如多发性硬化(MS)和帕金森病。此次公布的结果显示,A-005具有良好的耐受性,并能穿越血脑屏障。此外,A-005在CNS和外周实现了最大的TYK2抑制,并具有良好的药代动力学特征。基于这些数据,该公司预计在2025年下半年开始,在MS患者中进行2期临床试验。Assembly Biosciences公司公布了其在研下一代衣壳组装调节剂ABI-4334用于治疗慢性HBV感染患者的1b期临床试验数据。此次公布的结果显示,在首个150 mg剂量组中,ABI-4334显示出很强的抗病毒活性,在28天的治疗中,血浆HBV DNA平均降低了2.9 log IU/mL。此外,ABI-4334耐受性良好,具有良好的安全性,半衰期支持每日一次口服给药。VYNE Therapeutics公司公布了其口服小分子BET抑制剂VYN202的积极1a期临床试验结果。新闻稿指出,相对于BD1,VYN202对BD2具有潜在“class-leading”的选择性和效力。此次公布的结果显示,VYN202有潜力成为一种新型的、每日一次的口服药物,用于治疗广泛的免疫介导疾病。与1a期单剂量递增结果一致,VYN202展现了良好的安全性和耐受性特征,没有出现与早期选择性较低的BET抑制剂相关的药物相关不良事件。此外,VYN202在体外刺激试验中展现了强大的药理活性,包括靶点结合和显著抑制与几种免疫介导疾病相关的炎症生物标志物的证据。Epirium Bio公司宣布,美国FDA已批准其潜在“first-in-class”的口服15-羟基前列腺素脱氢酶(15-PGDH)抑制剂MF-300的IND申请,用于治疗肌肉减少症或年龄引起的肌无力。15-PGDH是一种能将前列腺素E2(PGE2)转化为非活性代谢物的酶。MF-300旨在可逆地结合到15-PGDH的PGE2结合位点上,阻止该酶转化PGE2。在生化试验中,MF-300能够抑制15-PGDH的活性。在临床前的细胞和动物研究中,MF-300可稳定和增加PGE2的水平。2024年12月,该公司已开始为MF-300的1期剂量递增研究招募患者。Qurient宣布,美国FDA已批准其免疫肿瘤药物adrixetinib的IND申请,可开展针对慢性移植物抗宿主病(cGVHD)的1b期临床试验。Adrixetinib是一种针对Axl、Mer和CSF1R的选择性三重激酶抑制剂。这种药物能增强机体的免疫防御能力,提高癌细胞对治疗的敏感性。新闻稿指出,adrixetinib能够通过抑制CSF1R治疗cGVHD,并通过抑制Axl/Mer治疗白血病,这种双重作用机制有望为同时治疗这两种疾病提供潜在的益处。
