12月14日,中国国家药监局药品审评中心(CDE)网站最新公示,礼来(Eli Lilly and Company)重磅药物GIP/GLP-1受体双重激动剂替尔泊肽注射液新适应症上市申请获得受理,具体适应症尚未披露。根据CDE官网查询,这是替尔泊肽在中国递交的第五项上市申请,其中两项上市申请此前已经获NMPA批准。
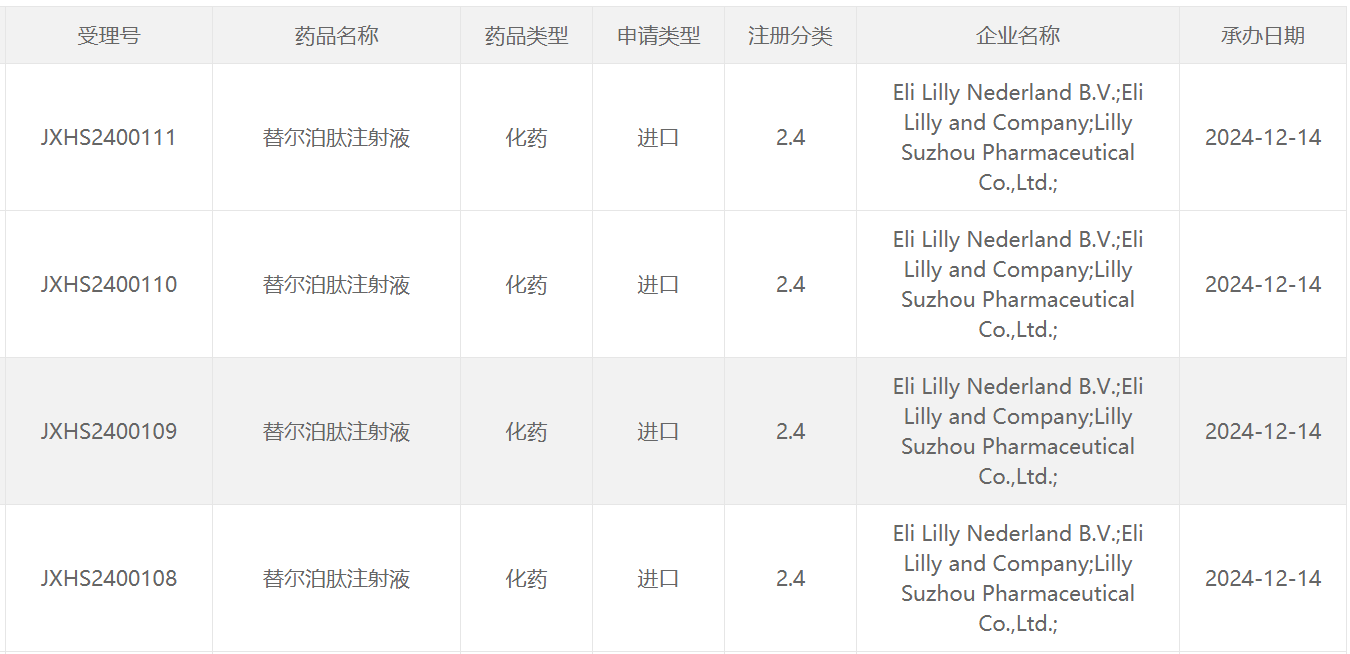
截图来源:CDE官网
替尔泊肽(tirzepatide)是一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体激动剂,每周一次注射。该产品分别于2022年5月和2023年11月获得美国FDA批准,用于糖尿病以及肥胖和超重患者。在中国,替尔泊肽于今年5月获批首个适应症,用于成人2型糖尿病患者血糖控制。今年7月,该产品再次获NMPA批准用于改善成人肥胖或伴有至少一种体重相关合并症的超重患者长期体重管理。目前,礼来也持续不断探索替尔泊肽在各种适应症上的应用。8月初,礼来宣布已经向欧洲和美国的监管机构递交申请,寻求批准替尔泊肽改善中重度阻塞性睡眠呼吸暂停(OSA)肥胖患者的打呼情况。礼来指出,这一适应症最快可能在今年年底之前获得FDA批准。SURMOUNT-OSA临床试验试验结果显示,与安慰剂相比,替尔泊肽平均减少患者呼吸暂停低通气指数(AHI)最高达62.8%,即每小时睡眠中减少约30次限制或阻塞气流的事件。在中国,替尔泊肽针对阻塞性睡眠呼吸暂停和肥胖适应证的国际多中心(含中国)临床研究也已经完成。今年11月21日,礼来还宣布已经开始向全球监管机构递交替尔泊肽治疗射血分数保留的心力衰竭(HFpEF)合并肥胖患者的适应症申请。SUMMIT3期临床研究已经达成了两个主要终点。与安慰剂相比,替尔泊肽降低心力衰竭事件风险(通过复合终点进行评估)达38%,降低心力衰竭住院风险达56%。值得一提的是,SUMMIT试验在中国的部分也已经完成。根据礼来官网的管线资料,替尔泊肽还针对多项适应症处于3期临床研究阶段,包括用于降低肥胖的发病率和死亡率、减少2型糖尿病患者的不良CV结局等。近日,该公司还公布了一项最新3b期试验积极数据,接受替尔泊肽治疗的受试者平均减重50.3磅(22.8公斤),而接受活性对照药物的受试者则平均减重33.1磅(15.0公斤)。
