1. RNAi疗法nucresiran治疗转甲状腺素蛋白(ATTR)介导淀粉样变性患者的早期临床试验结果亮眼,单次给药后第15天,患者平均血清转甲状腺素蛋白(TTR)水平降低超过90%,并维持至试验第6个月。
2. 抗体偶联药物PYX-201在一项1期临床试验中,在头颈部鳞状细胞癌患者中的疾病控制率(DCR)达100%,客观缓解率(ORR)达50%。
3. 用于治疗代谢功能障碍相关性脂肪性肝炎(MASH)和肥胖症的胰高血糖素样肽-1(GLP-1)/胰高血糖素双重受体激动剂pemvidutide在一项早期临床试验中展现积极疗效,患者用药12周后肝脏脂肪含量(LFC)相对基线减少68.5%。
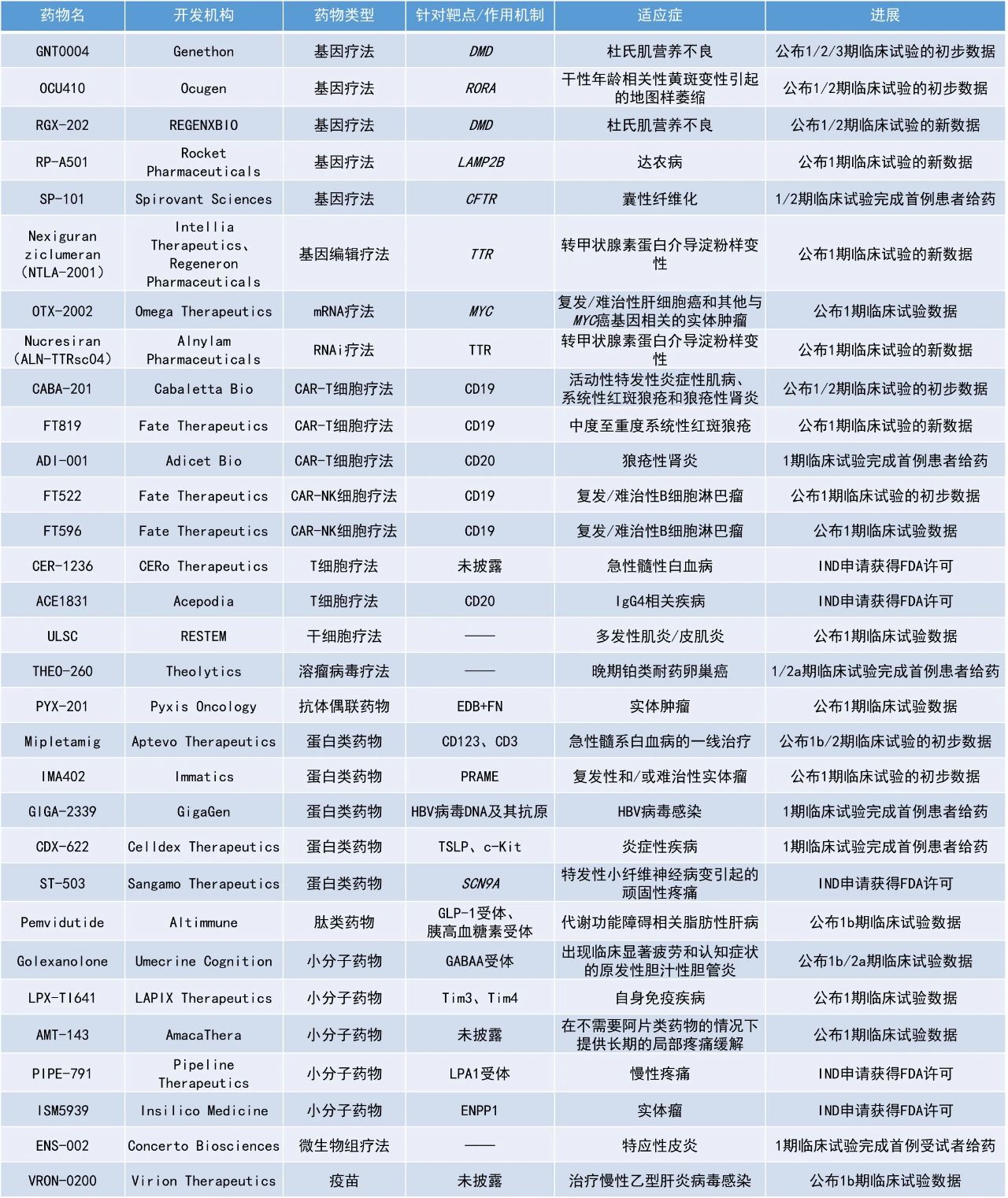
Nucresiran(ALN-TTRsc04):公布1期临床试验的新数据Alnylam Pharmaceuticals公司公布了其下一代RNAi疗法nucresiran(曾用名ALN-TTRsc04)用于治疗转甲状腺素蛋白介导淀粉样变性患者的1期临床研究的最新数据。Nucresiran通过Alnylam专有IKARIA平台所开发,旨在迅速降低突变型和野生型TTR的水平,从根本上治疗ATTR淀粉样变性。Nucresiran具有实现更深层次和更持久TTR快速降低的潜力,从而能够减少用药频率。此次公布的显示,单次给予300 mg或更高剂量的nucresiran,可在第15天实现患者平均血清TTR水平快速降低超过90%,且这一效果持续至试验第6个月。数据表明,nucresiran具有每半年或每年进行一次皮下注射的潜力。Alnylam计划在2025年第一季度公布3期临床开发方案。Pyxis Oncology公司公布了其候选抗体偶联药物PYX-201治疗多种类型实体瘤的1期剂量递增研究的初步积极数据。PYX-201以微管抑制剂(优化的auristatin)作为有效载荷,能独特地靶向肿瘤细胞外基质(ECM)中的一种非细胞结构成分——纤连蛋白B结构域(Extradomain-B Fibronectin,EDB+FN)。 截至2024年10月4日的数据,在6例疗效可评估的头颈部鳞状细胞癌患者中,观察到确认的ORR为50%,包括1例确认的完全缓解(CR)和2例确认的部分缓解(PR),DCR为100%。在所有6种研究者感兴趣的实体瘤(头颈部鳞状细胞癌、卵巢癌、非小细胞肺癌、HR+/HER2-乳腺癌、三阴性乳腺癌和肉瘤)患者(n=31)中,ORR为26%,研究人员还观察到剂量依赖性的缓解。此外,PYX-201通常耐受性良好,具有良好的安全性。Altimmune公司公布了pemvidutide治疗代谢功能障碍相关性脂肪性肝病(MASLD)的1b期试验的最新数据。Pemvidutide是一种GLP-1/胰高血糖素双重受体激动剂,目前正在开发用于治疗MASH和肥胖症。该研究中,94名超重或肥胖且LFC≥10%的受试者按1:1:1:1的比例被分配接受pemvidutide(1.2 mg、1.8 mg和2.4 mg)或安慰剂,每周一次皮下注射,持续12周。数据显示,患者血浆中与心血管不良后果相关的多类炎症脂质有所减少。患者接受pemvidutide治疗12周后,LFC相对基线减少了68.5%,总胆固醇和甘油三酯分别最多降低了12.2%和44.6%。研究结果支持pemvidutide对MASH合并症的潜在益处,包括动脉粥样硬化、心脏病和代谢综合征。Immatics公司公布了其下一代半衰期延长的T细胞受体(TCR)双特异性分子IMA402的1期剂量递增试验数据。IMA402靶向由HLA-A*02呈递的黑色素瘤抗原PRAME。PRAME是一种在各种实体瘤中经常表达的蛋白质,因此IMA402具潜力治疗广泛的癌症患者群体。截至2024年11月6日的数据,IMA402在接受治疗的33例患者中表现出良好的耐受性。最常见的治疗相关不良事件多为轻度至中度细胞因子释放综合征(CRS)和短暂的淋巴细胞减少症。早期药代动力学数据表明,IMA402的中位半衰期约为7天,有望支持每两周一次的给药方案。9例PRAME检测阳性或未接受PRAME检测的患者中有7例实现了靶病灶缩小,1例皮肤黑色素瘤患者获得了确认的PR,靶病灶已缩小40.2%。Mipletamig:公布1b/2期临床试验的初步数据Aptevo Therapeutics公司公布了其正在进行的1b/2期临床试验RAINIER中首例患者的治疗情况。该研究针对18岁及以上新确诊为急性髓系白血病且不符合强化诱导化疗条件的成人患者,旨在评估使用mipletamig联用标准治疗维奈托克和阿扎胞苷作为一线疗法的效果。APVO436是一种创新双特异性重组蛋白,它像两个单克隆抗体连接在一起,可以同时靶向肿瘤细胞表面的CD123和T淋巴细胞表面的CD3,从而将宿主免疫系统的T细胞重定向到患者的肿瘤细胞上,以快速和完全摧毁表面表达CD123的肿瘤细胞。此次公布的结果显示,首例患者在治疗的前30天内白血病细胞减少了90%,延续了先前研究中观察到的总体疗效趋势。Sangamo Therapeutics公司宣布,美国FDA批准了其在研表观遗传调节剂ST-503的IND申请,用于治疗特发性小纤维神经病变引起的顽固性疼痛(iSFN),这是一种慢性神经病理性疼痛。大量的证据表明,钠通道在介导神经病理性疼痛的病理生理过程中起着重要作用。开发特异性靶向Nav1.7钠通道的小分子药物具有挑战性,因为不同钠通道之间的结构相似性很高,难以实现选择性并避免脱靶效应。ST-503以腺相关病毒(AAV)为载体,携带工程化的锌指抑制子(ZFR),能够特异性地靶向编码Nav1.7钠通道的人类基因SCN9A,该基因在疼痛信号传导中起关键作用。在动物模型中,通过直接靶向SCN9A基因,ST-503被证明可以特异性地减少感觉神经元中Nav1.7钠通道的表达,并在单次鞘内给药后显著减少对疼痛的高敏感性。临床前研究表明,ST-503在非人灵长类动物中具有良好的耐受性,观察到显著的Nav1.7减少且没有脱靶效应,这显示了ST-503治疗慢性神经病理性疼痛的潜力。Sangamo公司正在准备进行1/2期临床研究,以评估单次剂量ST-503的安全性、耐受性和初步疗效,该药物将通过鞘内给药的方式给予iSFN患者,并计划于2025年中期开始患者招募。Concerto Biosciences公司宣布,其用于治疗特应性皮炎的微生物组疗法ENS-002的1期临床试验已完成首例受试者给药。ENS-002是该公司利用一种名为kChip的强大筛选技术,从超过600万个皮肤微生物群落中发现的可缓解湿疹的细菌组合,该组合中包含三种菌株,能够抑制皮肤炎症的关键驱动因素金黄色葡萄球菌(S.aureus)。与类固醇和免疫抑制剂相比,该候选疗法旨在解决特应性皮炎背后的微生物组缺陷,以提供一条缓解更持久且副作用更少的潜在新治疗途径。
