11月15日,中国国家药监局药品审评中心(CDE)官网最新公示,阿斯利康(AstraZeneca)申报的1类新药AZD0486获批两项临床试验默示许可,分别拟用于治疗成人既往未经治疗的滤泡性淋巴瘤;至少接受2线或以上系统性治疗的成人复发难治性滤泡性淋巴瘤。
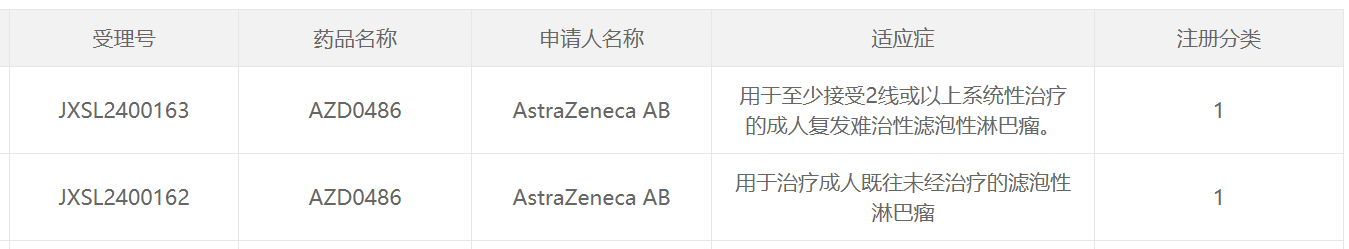 截图来源:CDE官网
截图来源:CDE官网
AZD0486的一端可与B细胞表面表达的CD19抗原相结合,另一端与T细胞表面的CD3受体相结合,从而将T细胞重定向到肿瘤细胞,诱导T细胞对肿瘤细胞的杀伤。2022年8月,阿斯利康宣布以总金额超12亿美元完成对TeneoTwo公司的收购,从而获得后者这款在研产品(先前名为TNB-486)。
研究表明,AZD0486含有独特的低亲和力抗CD3片段,旨在减少细胞因子释放,同时保留T细胞介导的对恶性B细胞的有效细胞毒性。沉默的Fc段可防止非特异性结合及抗体依赖性细胞毒性,并具有适合间歇性给药的长半衰期。
在今年的美国血液学会(ASH)年会当中,阿斯利康公布旗下多款血液学管线的临床结果。其中一项临床1期试验结果显示,复发/难治性滤泡性淋巴瘤(R/R FL)患者对2.4毫克及以上剂量的AZD0486高度应答,患者的总缓解率高达96%,完全缓解(CR)率达85%,且患者的最小残留病灶(MRD)阴性比率很高。
根据ClinicalTrials官网,阿斯利康正在开展一项评估AZD0486联合利妥昔单抗治疗此前未经治疗的滤泡性淋巴瘤的3期临床研究,以及一项针对复发或难治性B细胞非霍奇金淋巴瘤(包括滤泡性淋巴瘤)1期临床研究。
在中国,AZD0486治疗复发性或难治性B细胞急性淋巴细胞白血病此前已经获CDE临床试验默示许可。本次在中国获批新的IND,意味着其在中国也迎来新的研发进展。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..