本期看点
1. KRAS G12D共价小分子抑制剂RMC-9805用于经治胰腺导管腺癌(PDAC)患者的早期临床结果亮眼,客观缓解率(ORR)达30%,疾病控制率(DCR)为80%。
2. 潜在“first-in-class”合成致死疗法IDE397在一项1期临床试验中展现积极结果,在甲硫腺苷磷酸化酶(MTAP)缺失的尿路上皮癌(UC)和非小细胞肺癌(NSCLC)患者中的DCR为93%。
3. 罗氏(Roche)用于治疗阿尔茨海默病的在研抗体trontinemab在一项1b/2a期临床试验中,使大多数接受较高剂量的患者大脑中的淀粉样蛋白斑块在28周时几乎全部清除。
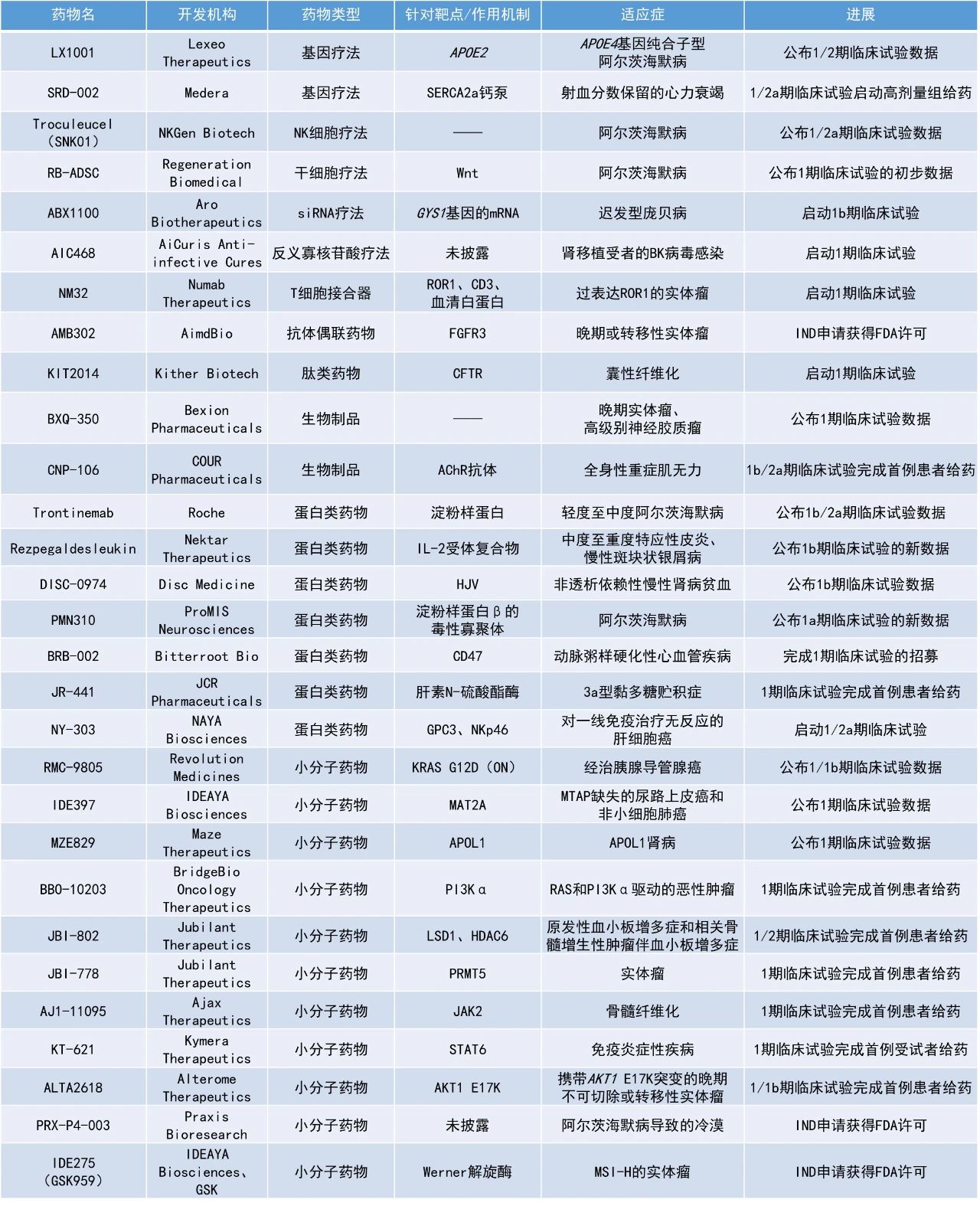
RMC-9805:公布1/1b期临床试验数据
Revolution Medicines公司公布了其小分子抑制剂RMC-9805在经治胰腺导管腺癌患者中的初步积极数据。RMC-9805是一款潜在“first-in-class”的口服KRAS G12D突变选择性共价抑制剂。RMC-9805通过和KRAS G12D以及与伴侣蛋白cyclophilin A蛋白之间形成稳定的高亲和力三复合物,能够破坏KRAS G12D(ON)与RAF激酶等下游效应物的相互作用,抑制KRAS G12D(ON)的下游信号传导。
在一项多中心、开放标签、剂量递增和剂量扩展的1/1b期研究RMC-9805-001中,截至2024年9月2日的数据,在推荐的2期剂量(每日一次1200 mg和每日两次600 mg)下,至少接受14周RMC-9805治疗患者的ORR达30%(n=12),DCR为80%(n=32)。此外,RMC-9805显示出良好的安全性特征,并在不同剂量水平上普遍展现良好的耐受性。在每日服用1200 mg RMC-9805的患者中(n=99),超过10%的最常见治疗相关不良事件(TRAEs),包括胃肠道相关毒性(如恶心、腹泻和呕吐)以及轻微皮疹,主要为1级且持续时间有限。
IDE397:公布1期临床试验数据
IDEAYA Biosciences公司公布了其在研疗法IDE397在MTAP缺失的尿路上皮癌和非小细胞肺癌患者中进行的1期临床试验扩展数据。IDE397是一款潜在“first-in-class”甲硫氨酸腺苷转移酶2α(MAT2A)小分子抑制剂。MTAP缺失的肿瘤因为肿瘤代谢途径的变化对它尤其敏感。MTAP缺失患者群体估计占所有实体瘤的15%,包括大约15%的非小细胞肺癌、28%的食道癌、26%的膀胱癌、和10%的胃癌患者。
此次公布的数据显示,在27名可评估患者中,1例患者获得完全缓解(CR),8例患者获得部分缓解(PR)。这9例患者的缓解均已通过RECIST 1.1评估确认,包括4例UC患者(其中1例为CR)和5例NSCLC患者。此外,16例患者疾病稳定。在27名可评估患者中,疾病控制率约为93%。
Trontinemab:公布1b/2a期临床试验数据
罗氏公布了其在研抗体trontinemab用以治疗轻度至中度阿尔茨海默病(AD)患者的1b/2a期试验积极结果。Trontinemab是一款运用罗氏大脑穿梭(brain shuttle)技术的靶向淀粉样蛋白单克隆抗体。它将靶向淀粉样蛋白的单克隆抗体与可以和转铁蛋白受体相结合的蛋白域融合,可以有效协助抗体穿越血脑屏障,在用药3-6个月后可以快速有效地清除大脑中的淀粉样蛋白沉积。
此次公布的结果显示,两种较高剂量(1.8 mg/kg与3.6 mg/kg)的trontinemab在第12周时便导致患者大脑淀粉样蛋白水平迅速且显著地降低。在28周时,大多数接受较高剂量的患者大脑中的淀粉样蛋白斑块几乎全部清除。此外,trontinemab不仅降低了淀粉样蛋白水平,还降低了阿尔茨海默病的其他生物标志物的水平,包括脑脊液当中的总tau蛋白与pTau181等。研究人员认为总体上trontinemab具有良好的安全性,并指出观察到的水肿/渗出相关的淀粉样蛋白相关成像异常(ARIA-E)病例数量非常有限。
IDE275(GSK959):IND申请获得FDA许可
IDEAYA Biosciences公司宣布其候选小分子IDE275(GSK959)向美国FDA递交的IND申请已获批准,将启动1期临床试验。IDE275是一种由IDEAYA与GSK合作发现的潜在“first-in-class”的小分子Werner解旋酶(WRN)抑制剂。在临床前研究中,IDE275在微卫星不稳定性高(MSI-H)生物标志物背景下展示了强烈的选择性合成致死效应,包括在源自结直肠、子宫内膜和胃癌的MSI-H细胞异体移植模型(CDX)和患者异体移植模型(PDX)中,IDE275单药治疗诱导了肿瘤消退。预计IDE275的1期临床试验将于2024年第四季度启动。GSK是IND申请的赞助方,并计划在1期临床试验中将IDE275作为单药以及与PD-1抑制剂联用治疗MSI-H肿瘤患者。
NM32:启动1期临床试验
Numab Therapeutics宣布启动其靶向受体酪氨酸激酶样孤儿受体1(ROR1)和T细胞受体相关抗原CD3的新一代三特异性免疫肿瘤治疗药物NM32的1期临床试验。NM32是潜在“first-in-class”ROR1靶向半衰期增强型T细胞接合器。ROR1是一种肿瘤相关抗原,在实体瘤和血液恶性肿瘤中广泛表达。NM32的分子量较小,与较大的免疫球蛋白G分子(目前CD3接合器的标准形式)相比,能够更有效地渗透肿瘤。NM32的第三个结合部分以血清白蛋白为靶点,延长了半衰期,方便实现两周一次的给药频率。
CNP-106:1b/2a期临床试验完成首例患者给药
COUR Pharmaceuticals公司宣布,其用于治疗全身性重症肌无力(gMG)患者的候选疗法CNP-106的1b/2a期概念验证临床试验已完成首例患者给药。CNP-106是一种使用可生物降解的纳米颗粒封装乙酰胆碱受体(AChR)的产品。gMG主要由体内产生的抗AChR抗体引起。这些抗体会阻断或破坏控制肌肉收缩的重要神经递质乙酰胆碱的神经信号传递给AChR,导致肌肉无法正常收缩。随着病情的发展,gMG可能会引发更严重的健康问题,比如肌无力危象、胸腺肿瘤、甲状腺功能异常以及其他自身免疫性疾病。CNP-106旨在下调或抑制针对AChR的T细胞和抗体水平,从而帮助改善患者的肌肉功能。
BBO-10203:1期临床试验完成首例患者给药
BridgeBio Oncology Therapeutics公司宣布,其用于治疗晚期实体瘤的候选小分子BBO-10203的1期临床试验已完成首例患者给药。BBO-10203是一种潜在“first-in-class”、口服生物可利用的RAS:PI3Kα断路器(breaker)。BBO-10203不直接抑制PI3Kα的催化活性,而是通过选择性地共价结合到PI3Kα的RAS结合域(RBD),阻断RAS和PI3Kα之间的相互作用,从而抑制RAS驱动肿瘤中的PI3Kα-AKT信号传导。这种选择性抑制不受限于PI3Kα和RAS的突变状态。在临床前模型中,即使在个位数纳摩尔浓度下也能完全抑制RAS驱动的pAKT信号。此外,在接受BBO-10203治疗的临床前动物模型中未观察到高血糖现象。BBO-10203有望为患有RAS和PI3Kα驱动的恶性肿瘤患者提供具有临床意义的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..