10月16日,中国国家药监局(NMPA)药品审评中心(CDE)官网最新公示,由Heidelberg Pharma申报的1类新药HDP-101获批临床,拟用于治疗B细胞成熟抗原(BCMA)阳性克隆性血液学疾病(如复发/难治性多发性骨髓瘤)。公开资料显示,这是一款靶向BCMA的抗体偶联药物(ADC),由华东医药合作开发。
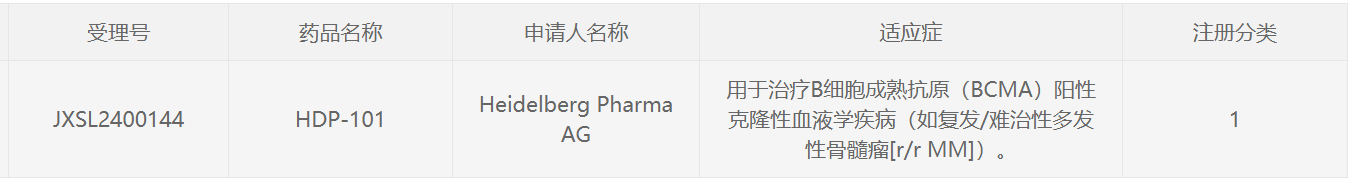 截图来源:CDE官网
截图来源:CDE官网
2022年,华东医药与Heidelberg Pharma公司达成合作,获得后者授予的两款ADC疗法在20个亚洲国家和地区的独家开发和商业化权益,其中就包括了这款靶向BCMA的ADC产品HDP-101(华东医药研发代号:HDM2027)。同时,华东医药获得Heidelberg公司35%的股权。
参考资料:
[1]中国国家药监局药品审评中心官网. Retrieved Oct 16, 2024, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]关于全资子公司获得药物临床试验批准通知书的公告. Retrieved Oct 16, 2024 from http://www.cninfo.com.cn/new/disclosure/detail?plate=szse&orgId=gssz0000963&stockCode=000963&announcementId=1221395939&announcementTime=2024-10-16
[3]Abstract CT067: The anti-BCMA antibody-drug conjugate HDP-101 with a novel amanitin payload shows promising initial first in human results in relapsed multiple myeloma. Retrieved Apr 05, 2024 from https://aacrjournals.org/cancerres/article/84/7_Supplement/CT067/742336/Abstract-CT067-The-anti-BCMA-antibody-drug
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..