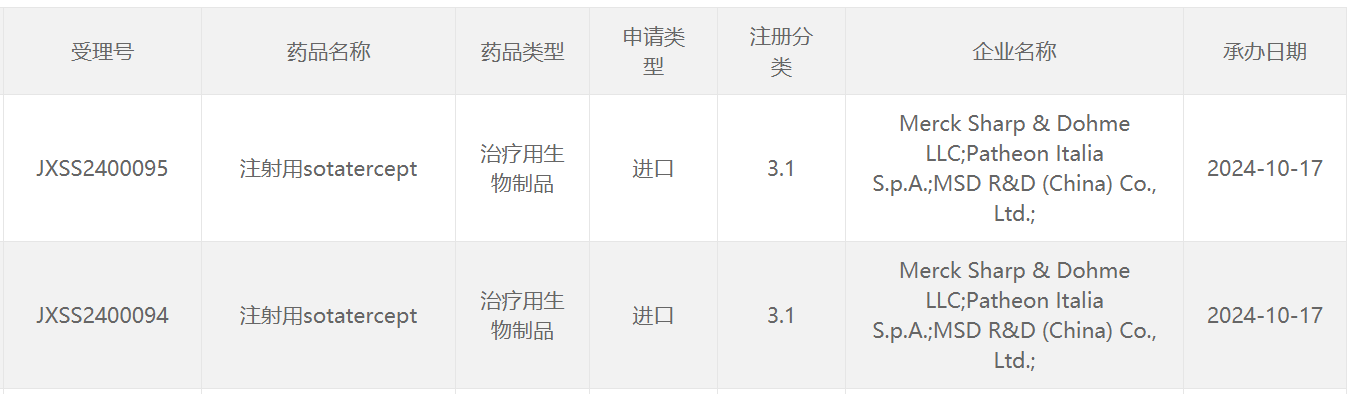
10月17日,中国国家药监局(NMPA)药品审评中心(CDE)官网最新公示,默沙东(MSD)申报的注射用sotatercept上市申请获得受理。公开资料显示,这是一款“first-in-class”新型激活素信号抑制剂类生物制剂,该产品已经于今年3月获得美国FDA批准上市,用于治疗肺动脉高压(PAH)。这款疗法此前被行业媒体Evaluate评为2024年潜在重磅的疗法之一。
截图来源:CDE官网
PAH是一种罕见、进行性、危及生命的血管疾病,当肺部的小动脉变厚并变窄时,会导致这些动脉内的压力增加,对心脏造成压力。PAH可引起心脏负荷明显增加,导致体力活动受限、心力衰竭和预期寿命缩短。PAH的发生涉及三个相关过程,包括炎症、细胞增殖和纤维化,这些过程在肺部小动脉的增厚、变窄和僵硬中起着重要作用,通常被称为“血管重塑”。目前批准的PAH疗法主要是作为血管扩张剂打开血管,但这些治疗无法逆转由炎症、增殖和纤维化引起的血管重塑。
Sotatercept是一款IIA型激活素受体(ActRIIA)融合蛋白。它将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。在临床前研究中,它可以逆转肺动脉壁和右心室的重塑。该产品也是默沙东于2021年以约115亿美元收购Acceleron Pharma公司获得的关键疗法。此前,sotatercept已获得FDA授予的突破性疗法认定,用于治疗肺动脉高压。
FDA批准sotatercept是基于一项随机双盲,含安慰剂对照的关键性3期临床试验STELLAR的结果。2023年3月,默沙东公布了该关键性3期临床试验完整结果,该研究结果也在《新英格兰医学杂志》同步发表。
研究结果显示,在PAH患者中,sotatercept在治疗24周后将患者的6分钟步行距离(6MWD)与基线相比提高了40.8米。此外,sotatercept还对9项次要终点中的8项提供统计显著和具有临床意义的改善,包括WHO功能分级和肺血管阻力方面的改善。与安慰剂相比,在中位随访时间为32.7周时,它将患者的疾病临床恶化或死亡风险降低84%。
默沙东此前新闻稿表示,这些具有里程碑意义的结果彰显了在肺动脉高压治疗领域,sotatercept以及与血管过度增殖和病理性重塑相关的靶向细胞信号方法的治疗潜力。
2023年9月,默沙东公布了该研究的一项探索性事后分析结果。结果表明,sotatercept在治疗PAH患者24周后,可缩小心脏右侧大小,并且改善右心室功能和血液动力学指标。
在中国,sotatercept于去年9月获批临床,针对适应症即为肺动脉高压。根据药物临床试验登记与信息公示网站,默沙东此前已经完成了一项在健康中国受试者中评价sotatercept的安全性、耐受性和药代动力学的单次给药1期临床研究。本次该产品在中国的上市申请获得受理,意味着其研发进程迎来重要进展,有望在不久的将来造福中国患者。
参考资料:
[1]中国国家药监局药品审评中心官网. Retrieved Oct 17, 2024, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]默沙东公布在研药物sotatercept III期STELLAR研究数据. Retrieved Mar 7,2023. From https://mp.weixin.qq.com/s/viNQdtj1-LTjojrhAKWTIA
[3] Prescribing information. Retrieved March 26, 2024 https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761363s000lbl.pdf
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..