10 月 15 日,CDE 官网显示,恒瑞启动一项诺利糖肽注射液(SHR20004)III 期临床,主要研究目的是在二甲双胍联合或不联合另一种口服降糖药控制不佳的 2 型糖尿病(T2DM)患者中,证实 SHR20004 控制血糖的有效性优于安慰剂。
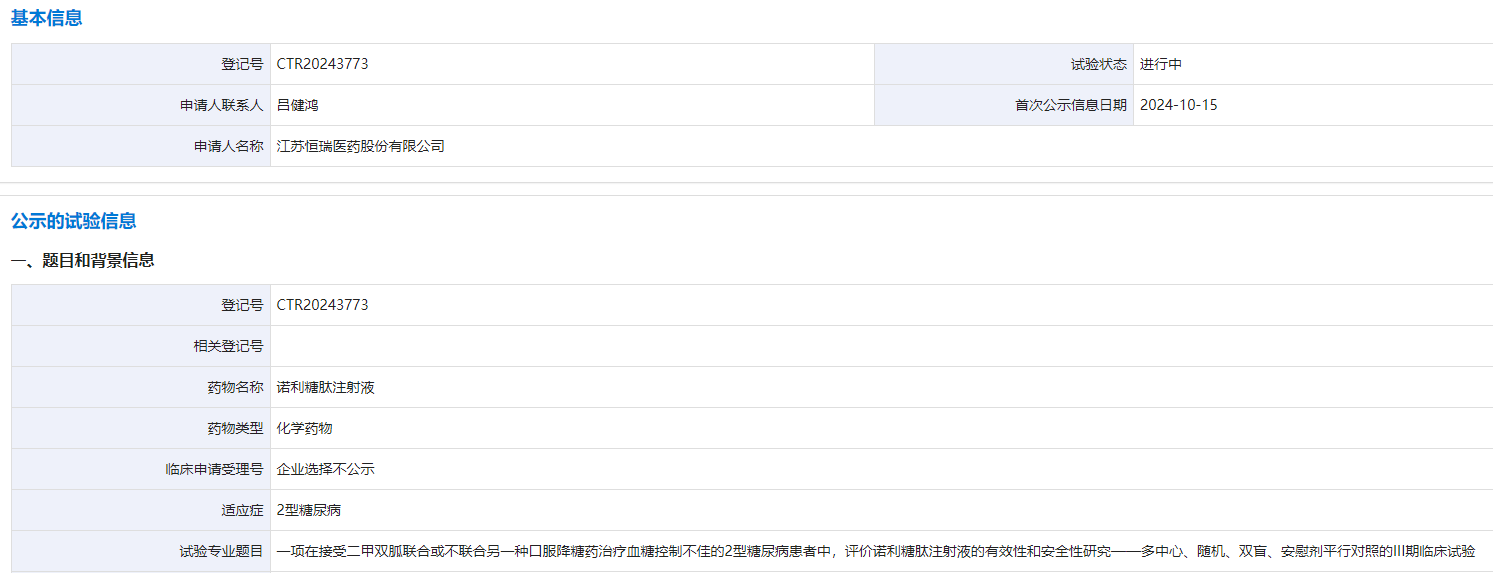
截图来源:CDE 官网
诺利糖肽是一种 GLP-1 受体激动剂,给药频率为一天一次皮下注射,最早由恒瑞和豪森共同拥有,目前在研适应症主要为肥胖和 2 型糖尿病,其中,肥胖适应症目前正处于 II 期临床。
2023 年 12 月,恒瑞公布了诺利糖肽在中国非糖尿病肥胖成年患者中的疗效。
在一项为期 24 周的随机、双盲、安慰剂对照的 2 期临床试验中(NCT04799327),254 名体重指数为 28.0-40.0 kg/m2 且无糖尿病的肥胖成年人被纳入。受试者最以 1:1:1 的比例随机分为三个剂量组: 0.12,0.24 或 0.36 mg 的研究治疗。主要终点是体重从基线到第 24 周的变化。
结果显示,在所有剂量组中,到第 24 周,最小二乘平均体重减少范围 8.03-8.50 公斤,而安慰剂组为 3.65 公斤 (所有 p 值 < .0001)。
在三个剂量组中 (0.12,0.24,0.36 mg/天),与安慰剂组相比,体重减轻≥5% 比例分别为 68.8% ,60.0% ,73.0%;体重减轻≥10% 的分别为 37.5% ,36.9% ,39.7%;而安慰剂组体重减轻≥5% 为 29.0%,体重减轻≥10% 为 8.1%。
结果显示与安慰剂相比,每日一次皮下注射诺伊格鲁肽可显著减少 24 周的体重,并且具有可控的安全性,主要不良反应涉及胃肠道疾病(如恶心,腹泻和呕吐)。
国内企业 GLP-1 赛道
恒瑞管线数量位居第一
GLP-1 赛道在国内已经如火如荼,就布局该靶点新药的企业来看,除了三家跨国药企外,恒瑞在该靶点上布局的新药管线数据已经位居全球第四名了(与华东医药并列,非积极或者不活跃项目不统计)。
具体来看,恒瑞的 7 款 GLP-1 靶点新药中,有 4 款属于重点推进产品已经进展到 III 期临床阶段,分别为 HR17031(皮下注射)、HRS9531(皮下注射)、HRS-7535(口服)和诺利糖肽(皮下注射)。
HR17031 皮下注射,每日一次
HR17031 是恒瑞研发的一款是基础胰岛素类似物(INS068)和 GLP-1 受体激动剂(SHR20004)的固定复方制剂,每日给药一次,在 2024 ADA 大会上,恒瑞公布了 HR17031 在 2 型糖尿病患者中的临床结果。
这是一项 II 期临床研究,在接受口服降糖药(OADs)治疗仍血糖控制不佳的 2 型糖尿病患者中,评估 HR17031 相比两单药组分的有效性和安全性。
结果显示,第 26 周时,与 INS068 组和 SHR20004 组的受试者相比,HR17031 组 HbA1c 较基线降低幅度更大(-2.4% vs-1.5%、-1.7%),表明 HR17031 降糖效果优于 INS068 和 SHR20004。HR17031 组可使更多患者达到 HbA1c<7% 和<6.5% 的目标(<7%,81.4%;<6.5%,74.3%),高于 INS068(47.8%;26.4%)和 SHR20004(55.6%;41.1%)。
与 INS068 相比,HR17031 可减轻体重(-0.1 kg vs 2.0 kg)。使用 HR17031 的胰岛素日剂量低于 INS068(30.3 U/d vs 38.1 U/d)。
安全性方面,<3.0 mmol/L 的低血糖事件发生率为 HR17031(5.5%)和 INS068(4.4%)相似,未发生预期外的安全问题。
HRS9531 皮下注射,每周一次
HRS9531 是恒瑞研发的一种 GLP-1/GIP 双受体激动剂,目前正在开展用于肥胖、2 型糖尿病、多囊卵巢综合征、射血分数保持的心力衰竭合并肥胖等适应症。
在 2024 ADA 大会上,恒瑞公布了 HRS9531 在肥胖患者中的临床结果。这是一项随机、双盲、安慰剂对照的 II 期研究中,249 名 BMI 在 28-40 kg/m2 之间的中国成年人以 1:1:1:1:1 的比例被随机分为 5 组,按所在组别依次对应接受每周一次的 HRS9531 皮下注射(1.0 mg、3.0 mg、4.5 mg 和 6.0 mg)或安慰剂,持续治疗 24 周。主要终点是第 24 周时体重较基线变化的百分比。
结果显示,与基线相比,第 24 周时接受 HRS9531 皮下注射 1.0 mg、3.0 mg、4.5 mg 和 6.0 mg 组体重的最小二乘平均值(LS mean)百分比变化分别为-5.4%、-13.4%、-14.0% 和-16.8%,而安慰剂组为-0.1%。体重减轻≥5% 的受试者比例分别为 52.0%、88.2%、92.0%、91.8% 和 10.2%。
此外,HRS9531 在降低血压、改善血糖控制和降低甘油三酯水平方面优于安慰剂。HRS9531 组收缩压从基线到第 24 周的 LS mean 变化范围为-4.46 至-8.33 mmHg(安慰剂组:-0.41 mmHg),HRS9531 组腰围变化范围为-5.14 至-12.73 cm(安慰剂组:-1.82 cm)。
总体来看,HRS9531 可有效降低体重、血压、血糖和甘油三酯,且具有良好的安全性。这些数据将支持 HRS9531 用于肥胖治疗的进一步临床开发。
HRS-7535 口服,每日一次
是一种新型口服小分子 GLP-1R 激动剂,目前正在 2 型糖尿病和减重临床研究。
2023 年 12 月,恒瑞公布了 HRS-7535 的 I 期临床结果。
在剂量递增部分的第 29 天,接受 HRS-7535 的参与者的体重从基线减少的平均值 (百分比) 为 4.38 kg (6.63%) ,而接受安慰剂的参与者为 0.8 kg (1.18%)。
HRS-7535 具有与其他 GLP-1RAs 一致的安全性和耐受性,并且表现出适合于每日一次给药的 PKs。
4 款处于早期阶段
除了上述进展到 III 期临床的 GLP-1 靶点新药外,恒瑞还有 4 款新药处于早期阶段,包括 HRS9531 片(I 期临床)、SHR-1816(I 期临床)、SHR-2042(批准临床,不活跃)、HRS-4729(临床前)。
其中 HRS9531 片是 HRS9531 的口服给药形式,其用于 2 型糖尿病和肥胖适应症均进入 1 期临床阶段;
SHR-1816 一款双靶 GCGR 抗体/GLP-1 融合蛋白,其用于 2 型糖尿病已经进入 1 期临床;
SHR-2042 也是一款口服 GLP-1 类似物,主要用于 2 型糖尿病及肥胖症的治疗。2018 年在国内获批临床后,一直未检测到有新的研发进展。
HRS-4729 恒瑞研发的下一代肠促胰岛素产品,可通过激活 GCGR/GIPR/GLP1R,保护胰岛的同时提高胰岛素分泌,控制血糖,目前尚处于临床前开发阶段。全球范围内尚无同类产品上市。
值得一提的是,恒瑞在今年 5 月达成的一项超 60 亿美元的合作中,已经将 GLP-1 产品组合(HRS-7535、HRS9531 与 HRS-4729)的大中华区以外的独家权利有偿许可给美国 Hercules 公司。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..