9月28日,中国国家药监局药品审评中心(CDE)官网最新公示,诺华(Novartis)盐酸伊普可泮胶囊以注册分类5.1类申报的新适应症上市申请获得受理,具体适应症尚未披露。伊普可泮是一款特异性补体B因子口服抑制剂。公开资料推测其本次申报的适应症可能为用于降低成人IgA肾病(IgAN)患者的蛋白尿水平。针对该适应症,伊普可泮已经于今年8月获得美国FDA批准。
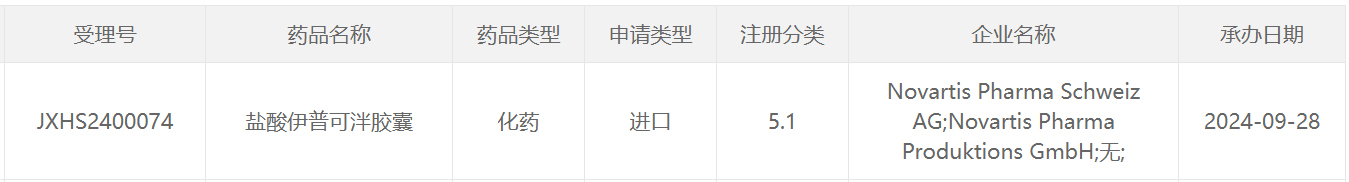
截图来源:CDE官网
伊普可泮胶囊(iptacopan,LNP023)是一种口服特异性替代补体途径因子B抑制剂,能高效抑制补体替代通路中因子B。它可能在治疗多种替代通路功能异常导致的疾病同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。这款产品曾被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
在全球范围内,伊普可泮在2023年12月获得FDA批准上市,成为治疗成人阵发性夜间血红蛋白尿症(PNH)的首个口服单药疗法。今年8月,FDA再次批准伊普可泮新适应症,用于降低成人IgA肾病(IgAN)患者的蛋白尿水平,这些患者有疾病迅速进展的风险。
在中国,伊普可泮于今年4月获NMPA批准首个适应症,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。9月5日,该产品的第三项上市申请获CDE受理,并拟纳入优先审评。本次是伊普可泮第四次在中国申报上市。
根据诺华此前公开资料,FDA批准伊普可泮用于降低成人IgA肾病(IgAN)患者的蛋白尿水平这一拓展适应症,主要基于随机双盲,含安慰剂对照的3期临床试验APPLAUSE-IgAN的积极结果。这项试验在518名成人原发性IgAN患者中评估伊普可泮的疗效和安全性。
中期分析数据显示,与接受安慰剂和支持性治疗的患者相比,伊普可泮治疗组患者在接受治疗9个月后蛋白尿减少38.3%,达到试验主要终点。该试验的另一项主要终点是通过测量24个月内年度eGFR斜率来评估伊普可泮减缓IgAN进展的能力,该数值预计在2025年研究完成时公布。
根据中国药物临床试验登记与信息公示平台官网,诺华正在中国开展针对IgA肾病患者的两项国际多中心(含中国)3期临床研究,分别旨在评价伊普可泮相比安慰剂对原发性IgAN患者蛋白尿减少和减缓疾病进展的疗效和安全性;以及评估开放标签伊普可泮的长期安全性和耐受性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..