9 月 25 日,CDE 网站显示,强生的 EGFR×c-Met 双抗埃万妥单抗注射液(皮下注射)已在国内申报上市,并获得受理。今年 6 月,埃万妥单抗皮下注射剂型已向美国 FDA 申报上市,用于治疗 EGFR 突变型非小细胞肺癌。临床试验数据显示,皮下注射埃万妥单抗中位给药时间缩短至 4.8 分钟,而静脉注射版埃万妥单抗的中位给药时间则需要 5 小时。此外,与静脉输液相比,皮下注射埃万妥单抗组出现用药相关反应 (ARR) 率和静脉血栓栓塞事件 (VTE) 的患者也较少。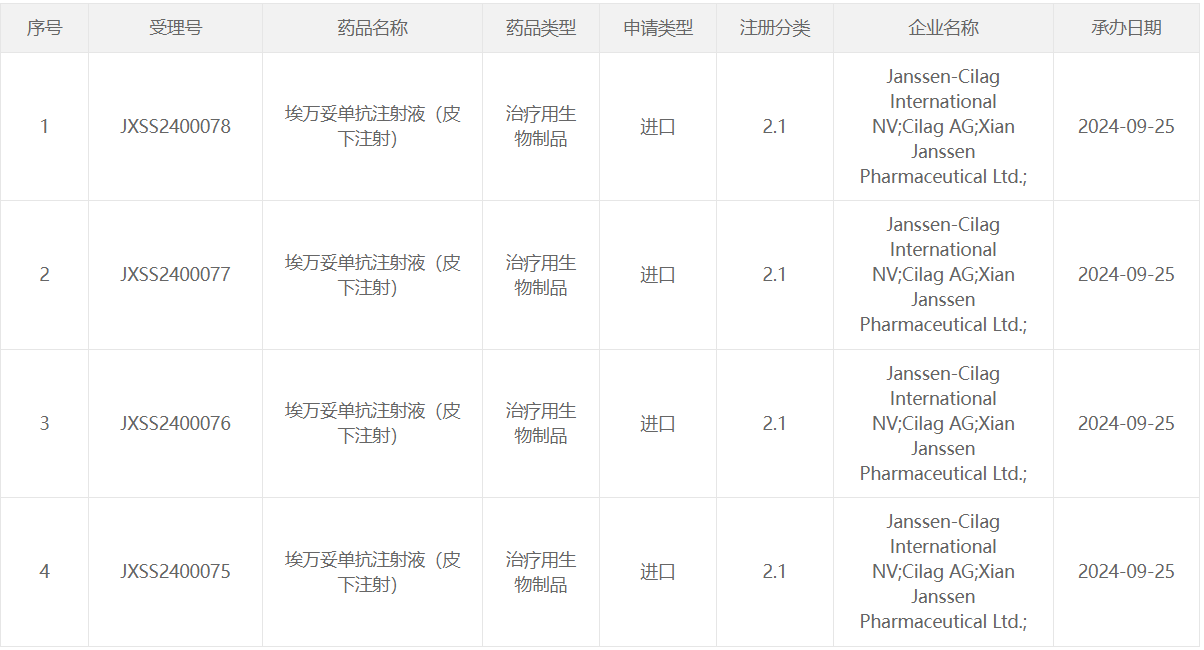
截图来源:CDE官网埃万妥单抗是全球首个获批的 EGFR×c-Met 双抗,该药的静脉注射剂型已在美国和欧盟获批上市多项适应症,包括:
- 单药用于治疗 EGFR ex20ins 突变 NSCLC(二线);
- 与卡铂和培美曲塞联合用于 EGFR ex20ins 突变 NSCLC(一线);
- 与标准化疗联合用于治疗 EGFR 外显子 19 缺失 (ex19del) 或 L858R 替代突变的局部晚期或转移性 NSCLC(二线);
- 联合拉泽替尼用于一线治疗 EGFR 外显子 19 缺失或外显子 21 L858R 替代突变的局部晚期或转移性 NSCLC(该适应症仅美国获批)。
在中国,静脉注射版埃万妥单抗已递交了多个上市申请,其首个申请于 2023 年 10 月获 CDE 受理,Insight 数据库预测该申请有望于明年一季度获批。本次申报上市的是埃万妥单抗皮下注射剂型。今年 6 月,强生已向 FDA 递交埃万妥单抗皮下注射剂型的 BLA,申请用于治疗静脉注射版埃万妥单抗已获批或提交的所有 NSCLC 适应症。2024 年 ASCO 年会上,研究人员曾公布了 Ⅲ 期 PALOMA-3 研究 (NCT05388669) 的数据。PALOMA-3 研究旨在评估皮下注射埃万妥单抗+拉泽替尼与静脉注射埃万妥单抗单抗+拉泽替尼,在奥希替尼和化疗治疗后进展的 EGFR 突变晚期或转移性 NSCLC 患者中的药代动力学 (PK)、疗效和安全性。其中,拉泽替尼是强生开发的一种第三代 EGFR-TKI。Ⅲ 期 PALOMA-3 研究数据显示,皮下注射埃万妥单抗的总体反应率与静脉注射给药相当,皮下注射埃万妥单抗还显示出显著缩短的给药时间,输液相关反应减少了五倍,同时总生存期、无进展生存期和反应持续时间更长。具体地:
- 皮下注射组的 ORR 为 30%,静脉注射组的 ORR 为 33%;中位 PFS 方面,皮下注射组为 6.1 个月,明显长于静脉注射组的 4.3 个月。
- 与静脉注射组相比,皮下注射组出现输液相关反应和静脉血栓栓塞的患者较少。
- 皮下注射埃万妥单抗的首次输注中位给药时间缩短至 4.8 分钟(范围为 0-18),静脉注射埃万妥单抗的首次输注中位给药时间缩短至 5 小时(范围为 0.2-9.9)。
- 在第 1 个周期第 1 天,皮下注射组和静脉注射组分别有 85% 和 52% 的患者认为治疗方便;治疗结束时的治疗率分别为 85% 和 35%。
总体而言,研究认为皮下注射埃万妥单抗+拉泽替尼不劣于静脉注射埃万妥单抗+拉泽替尼,且具有一致的安全性、降低的输液相关反应 (IRR),同时可增加便利性并延长生存期。此外,研究人员还在 Ⅱ 期研究 PALOMA-2 (NCT05498428) 中,评估了皮下注射埃万妥单抗联合拉泽替尼和/或化疗一线治疗 EGFR 突变晚期或转移性 NSCLC 患者的疗效、安全性和 PK。2024 年 ASCO 上公布的数据显示,皮下注射埃万妥单抗+拉泽替尼在 EGFR 突变 NSCLC 的一线治疗中显示出与历史静脉注射埃万妥单抗+拉泽替尼相似的反应率,且安全性得到改善,包括显著降低的用药相关反应 (ARR) 率。此外,预防性抗凝可以安全实施并降低静脉血栓栓塞事件 (VTE) 的发病率。
Insight 数据库显示,全球范围内已有十多款同时靶向 EGFR 和 c-MET 的药物进入申报临床及其以上阶段,药物类型包括双特异性抗体、三特异性抗体、抗体偶联药物(ADC),但目前仅有埃万妥单抗获批上市。
