本期看点
1. 抗体偶联药物(ADC)rinatabart sesutecan(Rina-S)用于治疗表达叶酸受体α(FRα)的晚期卵巢癌患者,在一项早期临床试验中的疾病控制率(DCR)近90%。
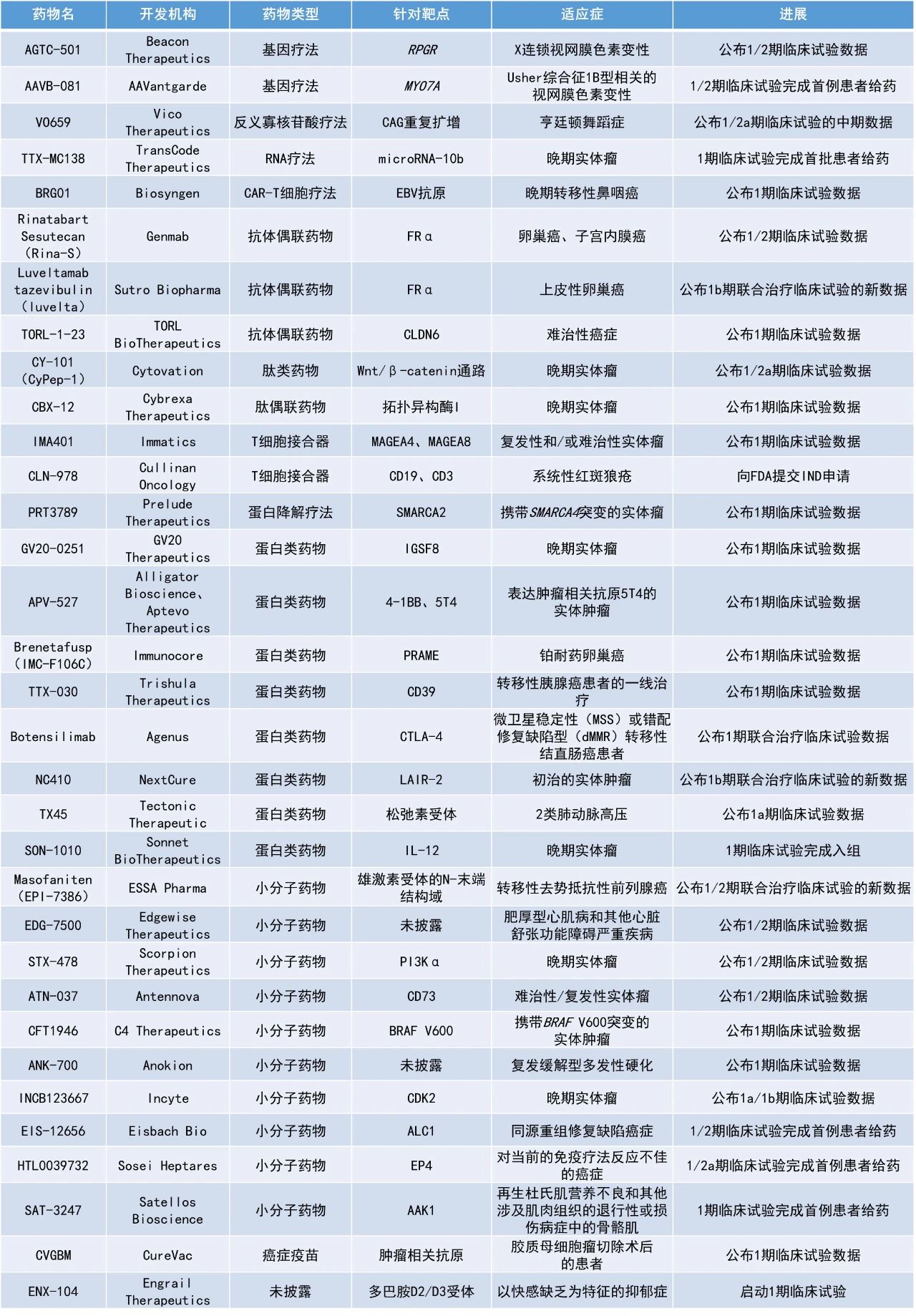
Rinatabart Sesutecan(Rina-S):公布1/2期临床试验数据
Genmab公司公布了其靶向FRα的抗体偶联药物Rina-S的1/2期临床试验数据。Rina-S旨在治疗比第一代FRα靶向ADC更广泛的患者群体。2024年1月,美国FDA授予Rina-S快速通道资格,用于治疗表达FRα的高级别浆液性或子宫内膜样铂耐药卵巢癌患者。
该研究的B部分将42名既往接受过治疗的经组织学或细胞学确诊的晚期卵巢癌(上皮性卵巢癌、原发性腹膜癌或输卵管癌)的患者随机分配接受100 mg/m2 Rina-S(n=22)或120 mg/m2 Rina-S(n=20)治疗。接受100 mg/m2 Rina-S治疗患者的确认的客观缓解率(ORR)为18.2%,4名患者获得了部分缓解(PR),15例患者实现疾病稳定(SD),DCR为86.4%。120 mg/m2组患者的ORR为50.0%,1名患者获得CR,4名患者获得了PR,8名患者为SD,DCR为88.9%。基于这些结果,Rina-S 120 mg/m2剂量已被选定在2024年开始的针对晚期卵巢癌患者的3期临床试验中进行进一步评估。
安全性方面,该研究中常见的治疗伴发不良事件(TEAE)包括贫血、中性粒细胞减少、恶心、血小板减少、白细胞减少、疲劳、呕吐、脱发和腹泻。剂量减少和治疗中止的情况较少,未观察到眼部毒性、神经病变或间质性肺病(ILD)的信号。
Masofaniten(EPI-7386):公布1/2期联合治疗临床试验的新数据
ESSA Pharma公司公布了其第二代抗雄激素药物masofaniten与恩杂鲁胺联合治疗转移性去势抵抗性前列腺癌患者的1/2期临床试验的新数据。Masofaniten是一种高选择性的雄激素受体N-末端结构域的口服小分子抑制剂。
此次公布的研究结果显示,该组合疗法32个给药周期测试的剂量水平下耐受性良好。无论患者先前的化疗状态如何,包括接受低于全剂量(120 mg)恩杂鲁胺的患者在内,mCRPC患者的PSA都有快速、深度且持久的降低。在所有队列中,88%(14/16)的患者达到了PSA90,69%(11/16)的患者在90天内达到PSA90,63%(10/16)患者达到PSA<0.2 mg/mL的水平。中位随访时间为15.2个月时,PSA进展的中位时间以及影像学无进展生存期尚未达到。
TTX-030:公布1期临床试验数据
Trishula Therapeutics公司公布了其与艾伯维(AbbVie)合作开发的抗CD39抗体TTX-030一线治疗转移性胰腺癌患者的1期临床试验结果。CD39是一种将三磷酸腺苷(ATP)转化为单磷酸腺苷(AMP)的酶,是在肿瘤微环境中生成腺苷的初始步骤。TTX-030能够阻止免疫抑制性胞外腺苷的生成,并维持高水平的免疫激活性胞外ATP,进而刺激树突状细胞和骨髓衍生细胞,促进先天性和适应性抗肿瘤免疫反应。
该1期临床试验评估了TTX-030+吉西他滨/白蛋白结合型紫杉醇联合使用±budigalimab(一种在研PD-1抗体)作为胰腺癌一线治疗的效果。在可评估疗效的人群(n=57)中,92%为一线转移性胰腺癌患者,8%为局部晚期不可切除患者,ORR为30%,其中3名患者获得了CR。中位无进展生存期(PFS)为7.5个月,中位总生存期(OS)为19.1个月。在28名高表达免疫相关生物标志物HLA-DQ的患者中,ORR为46%,中位PFS为9.6个月,中位OS为21.9个月。
安全性方面,两种治疗方案的耐受性良好,只有5名患者(8%)因不良事件(AE)中止治疗。最常见的不良事件为标准化疗方案中预期出现的不良反应,未见发生频率或严重程度的增加。
CFT1946:公布1期临床试验数据
C4 Therapeutics公司公布了其小分子降解剂CFT1946治疗携带BRAF V600突变的实体瘤患者的1期临床试验数据。CFT1946可以直接降解突变BRAF蛋白,消除其蛋白支架的功能,从而彻底规避RAF信号的异常激活。在临床前研究中,CFT1946导致BRAF-V600E突变体的降解,显著抑制MAPK信号传导,并且在降低BRAF-V600E细胞生存能力的同时并未影响野生型BRAF细胞。在BRAF V600E小鼠肿瘤模型中,CFT1946也导致肿瘤显著缩小。
截至2024年7月19日的数据,27名可评估患者中有16名的靶转移灶缩小,2名患者获得了CR。此外,CFT1946在迄今为止探索的5个剂量水平中表现出剂量依赖性的生物利用度。在迄今为止收集的所有可用的治疗后活检样本中,均观察到BRAF V600E蛋白的降解。安全性方面,CFT1946具有良好的耐受性和安全性,支持其作为单一疗法以及与MEK和EGFR抑制剂联用进行进一步的临床开发。
Brenetafusp(IMC-F106C):公布1期临床试验数据
Immunocore公司公布了brenetafusp在铂耐药卵巢癌患者中的1期数据。IMC-F106C是一种通过ImmTAX平台开发,靶向PRAME抗原的双特异性蛋白。该研究中,37例既往接受过大量治疗(中位线数为5线)的浆液性卵巢癌患者接受了 brenetafusp单药治疗,大多数患者既往接受过贝伐珠单抗(81%)和PARP抑制剂(59%)。31例可评估患者的DCR为58%,2例患者获得确认的PR。在所有37例患者中,中位PFS为3.3个月,6个月时的总生存率为73%。在可评估循环肿瘤DNA(ctDNA)的29例患者中,31%获得了分子学缓解。
16例既往接受过大量治疗(中位线数为4线)的铂类耐药卵巢癌患者接受了brenetafusp联用化疗的治疗,大多数患者既往接受过贝伐珠单抗(75%)和PARP抑制剂(75%)。Brenetafusp联合化疗的安全性与每种单独药物的预期特征一致。13例可评估患者的DCR为69%,3例患者获得PR。在可评估ctDNA的11例患者中,82%获得了分子学缓解。
IMA401:公布1期临床试验数据
Immatics公司公布了其下一代半衰期延长的T细胞受体(TCR)双特异性抗体平台的首个候选药物IMA401的概念验证临床数据。IMA401靶向HLA-A*02呈递的肽,该肽来源于两种不同的癌症相关蛋白,即黑色素瘤相关抗原4和/或8(MAGEA4/8)。
来自首次人体1期剂量递增试验的数据表明,IMA401单药治疗具有初始抗肿瘤活性和可控的耐受性。患者群体包括35名既往接受过大量治疗的患者,共涉及16种不同的实体瘤类型。在MAGEA4/8水平高且接受相关IMA401剂量的患者人群中,ORR为29%,DCR为53%。此外,在头颈部鳞状细胞癌、神经内分泌肿瘤、皮肤和粘膜黑色素瘤患者中观察到客观缓解,包括长达超过13个月的持久PR和深度缓解(肿瘤缩小≥50%)。药代动力学数据表明,IMA401的中位半衰期为16.9天,支持当前的每两周一次的给药方案和未来延长至四周一次的给药方案。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..