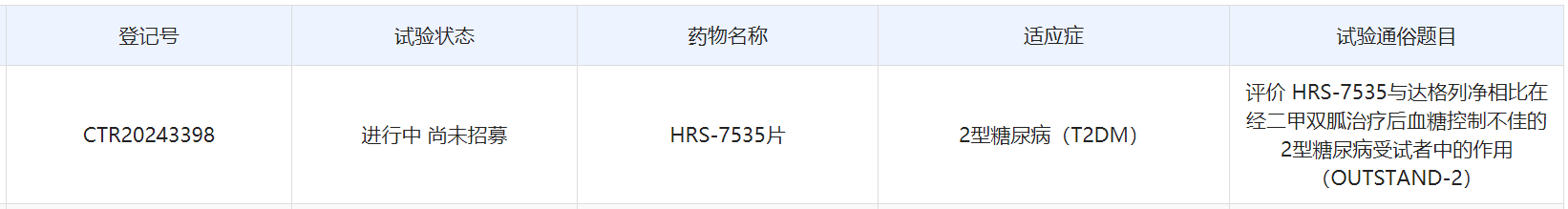
截图来源:中国药物临床试验与信息公示平台官网
恒瑞医药此前已经在2023年美国糖尿病协会(ADA)科学年会上公布了HRS-7535的1期研究结果。该研究纳入年龄18~55岁、体重指数(BMI)19.0~28.0 kg/㎡,糖化血红蛋白(HbA1c)<6.2%的明显健康成人。在单次递增剂量(SAD)中,健康受试者随机(6:2)接受HRS-7535(15mg、60mg和120mg)或安慰剂治疗。在多次递增剂量(MAD)中,健康受试者随机(18:6)接受每日HRS-7535[120mg(30/60/90/120mg滴定方案)]或匹配的安慰剂治疗4周。
研究结果显示,参与SAD和MAD的受试者各有24例。两组中治疗期间出现的不良事件(TEAE)均为轻度。在MAD中,使用HRS-7535的受试者第29天时的体重自基线平均下降4.38kg。研究人员认为,无论SAD还是MAD,HRS-7535均具有可接受的安全性和良好的PK/PD;此外,在健康受试者中还可观察到体重明显下降。这些发现支持HRS-7535在代谢综合征患者中的进一步临床探索。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..