看点
申报情况
8月CDE共受理新的药品注册申请以品种(按药品+企业维度)统计1159个(受理号1558个),其中化药745个品种,中药251个品种,生物制品163个品种。
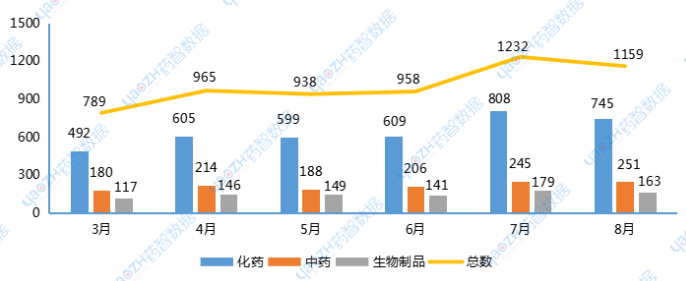
2024年3-8月注册受理药品类型品种情况
以审评任务类型统计,受理新药临床试验申请(以下简称IND)152个品种;新药上市许可申请(以下简称NDA)33个品种;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)339个品种);仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)40个品种。
以注册分类统计,1类创新药受理129个品种,其中创新化学药申请62个品种,创新中药申请4个品种,创新生物制品申请63个品种。2类改良型新药注册申请受理43个品种,IND申请27个品种,NDA申请17个品种。
创新药及改良型新药的ATC分类主要集中于抗肿瘤领域,其次分布在神经系统、消化道领域等。剂型以注射液、片剂为主。申报品种数最多的企业是正大天晴药业集团,共计申报7个品种;其次为强生制药,申报4个品种。
完成审批情况
8月CDE完成审批851个品种(受理号1161个),化药511个品种,中药185个品种,生物制品155个品种。以审评任务类型统计,IND申请完成审批144个品种,NDA申请完成审批19个品种,ANDA申请完成审批164个品种;一致性评价完成审批59个品种,其中通过一致性评价54个品种。
以药智审评结论统计,批准临床210个品种,批准生产138个品种,批准进口10个品种,未被批准62个品种。
创新型新药及改良型新药共计完成审批144个品种,其中IND申请共计完成审批137个品种,批准临床率达100%;NDA申请完成审批8个品种,上市批准率约为75%。
氟泽雷塞片
国家药品监督管理局通过优先审评审批程序附条件批准信达生物科技有限公司申报的1类创新药氟泽雷塞片,该药适用于至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。氟泽雷塞片是我国首个获批上市的KRAS G12C抑制剂,填补了近40年来我国在KRAS G12C靶向药领域的空白。
赛立奇单抗注射液
银屑病(俗称牛皮癣)是一种遗传与环境共同作用诱发的免疫介导的慢性、复发性、炎症性、系统性疾病,严重影响患者的生活质量。智翔金泰官微显示,赛立奇单抗注射液是其首款获批上市的产品,也是国内首个全人源IL-17A靶点药物,用于中、重度斑块状银屑病的治疗。
优先审评与突破性治疗品种名单
8月CDE共将10个品种纳入了优先审评名单,多数为国产品种。以药品类型来看,以生物制品为主,占70%,剩余品种全为化药,中药未有品种纳入优先审评。以纳入优先审评理由统计(同一品种存在多种理由),5个品种以“其他优先审评审批情形”排至首位,其次是“纳入突破性治疗药物程序”理由4个品种,“符合附条件批准的药品”理由1个品种,“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”理由1个品种。
突破性治疗品种名单中有7个品种,以生物制品为主,占比约71%。涉及非小细胞肺癌、骨髓瘤、肝细胞癌等适应症。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..