今日,礼来(Eli Lilly and Company)公布SUMMIT临床3期试验的积极顶线结果。分析显示,试验达成主要终点,与安慰剂相比,其重磅药物tirzepatide可将肥胖射血分数保留型心力衰竭(HFpEF)患者发生心衰相关事件的风险降低了38%。礼来将继续评估SUMMIT试验,并在即将召开的医学会议上公布详细数据。礼来计划从今年晚些时候开始向美国FDA和其他监管机构提交SUMMIT研究的结果。
SUMMIT是一项多中心、随机、双盲、平行、安慰剂对照的3期研究,旨在检视tirzepatide与安慰剂相比,对肥胖HFpEF成人患者(无论是否患有2型糖尿病)的疗效和安全性。该试验以1:1的比例随机分配731名受试者,让他们接受每周一次5毫克、10毫克、15毫克tirzepatide,或安慰剂皮下注射。
分析显示,与安慰剂相比,tirzepatide在两个主要终点方面均表现出统计学上显著的改善,即降低发生心力衰竭事件风险(包含心力衰竭紧急就诊或住院、强化口服利尿剂治疗或心血管死亡),以及通过堪萨斯城心肌病问卷(KCCQ)临床总结评分(CSS)衡量,显示患者的心力衰竭症状和身体限制获得改善,详细结果请见下表。
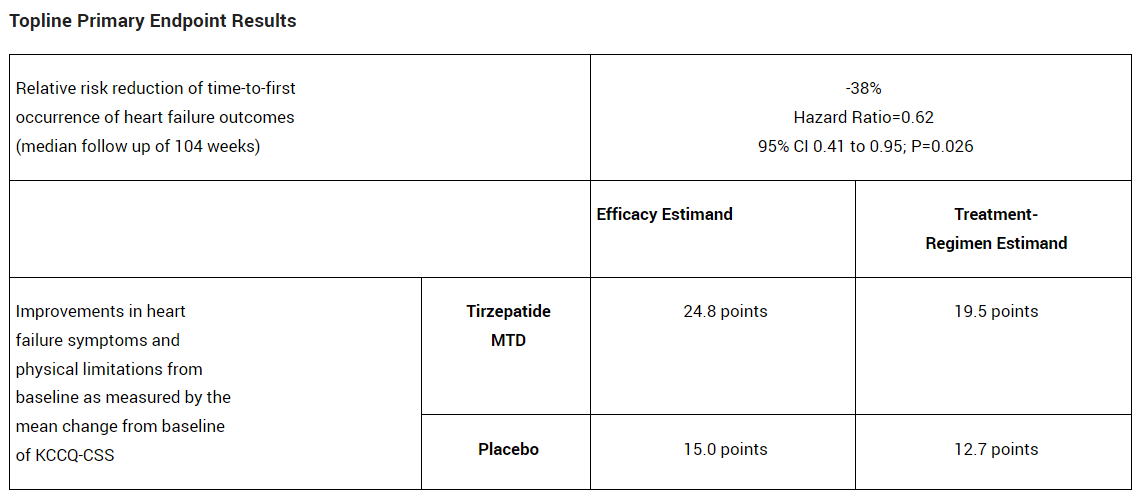
此外,分析亦显示该试验达成所有关键次要终点,包括通过6分钟步行测试距离(6MWD)测量的运动能力改善、炎症标志物高敏C反应蛋白(hsCRP)减少以及52周时平均体重较基线减轻。Tirzepatide使患有和不患有2型糖尿病的患者体重减轻了15.7%,此数值在安慰剂组为2.2%。
SUMMIT试验中tirzepatide的总体安全性与之前报告的试验结果一致。试验中报告的最常见不良事件主要是胃肠道不良事件,包含腹泻、恶心、便秘和呕吐,严重程度一般为轻度至中度。
Tirzepatide是一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂,可同时激活GLP-1受体和GIP受体介导的信号通路。GIP和GLP-1是调控血糖的天然的肠促胰岛素激素。Tirzepatide于2022年5月获得美国FDA批准(商品名:Mounjaro),用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。去年11月,tirzepatide再获FDA批准(商品名:Zepbound),用以使肥胖或超重成年患者减轻体重并保持体重稳定。值得一提的是,tirzepatide曾获FDA授予快速通道资格,用以治疗中重度阻塞性睡眠呼吸暂停肥胖患者。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..