根据PDUFA的预期目标日期,预计8月,美国FDA将对9款创新药物的批准做出监管决定,本文将对这些疗法进行相关介绍。
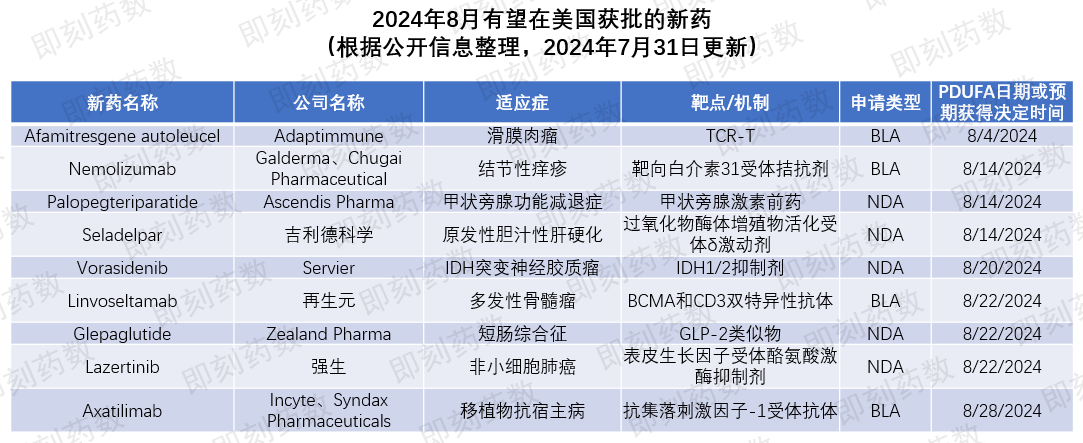
▲8月有望在美国获批的新药(药明康德内容团队制图,点击可见大图)
活性成分:Afamitresgene autoleucel(afami-cel)
适应症:滑膜肉瘤
公司名称:Adaptimune Therapeutics
Afami-cel是一种针对MAGE A4癌症靶点的工程化T细胞受体(TCR)T细胞疗法,被设计作为一种用于晚期滑膜肉瘤的一次性疗法。此前,美国FDA已授予其治疗软组织肉瘤的孤儿药资格和治疗滑膜肉瘤的再生医学先进疗法认定。根据新闻稿,如果获得批准,afami-cel将成为首款用于治疗实体瘤的工程化T细胞疗法,也是十多年来治疗滑膜肉瘤的首个有效疗法。
该疗法上市申请的递交主要是基于一项关键性研究SPEARHEAD-1中队列1的积极数据。该研究达到了主要疗效终点,患者的总缓解率(ORR)约为39%,中位缓解持续时间约为12个月。以往接受过两种或两种以上疗法的滑膜肉瘤患者的中位总生存期(OS)小于12个月,而接受afami-cel治疗患者的中位OS约为17个月,优于历史对照数据。接受afami-cel治疗有缓解的晚期滑膜肉瘤患者中,70%的人在治疗两年后仍然存活。其他分析表明,较高的afami-cel细胞持久性与较长的OS有关。
活性成分:Nemolizumab
适应症:结节性痒疹
公司名称:Galderma、Chugai Pharmaceutical
Nemolizumab是一种”first-in-class”单克隆抗体,它通过与IL-31受体α相结合,可以阻断IL-31的信号通路。IL-31是导致严重瘙痒的重要细胞因子。
结节性痒疹是一种炎症性皮肤病,其主要特征包括全身大面积的毁容性皮肤结节,以及剧烈的慢性皮肤瘙痒。之前公布的试验结果显示,38%接受nemolizumab治疗的中重度结节性痒疹患者的皮损得到完全或基本清除,而安慰剂对照组中这一比例仅为11%;56%的患者在接受nemolizumab治疗后瘙痒症状得到缓解,表现为PP-NRS瘙痒数值评定量表得分降低了至少4分,安慰剂对照组中仅有21%的患者报告瘙痒症状的缓解(P<0.0001)。
活性成分:Palopegteriparatide
适应症:甲状旁腺功能减退症
公司名称:Ascendis Pharma
Palopegteriparatide是一种甲状旁腺激素(PTH)前药,它旨在每天将PTH恢复至生理水平24小时,以解决甲状旁腺功能减退的短期症状和长期并发症。甲状旁腺功能减退症是一种罕见的内分泌疾病,其特征是PTH水平不足,导致血液中低钙和磷酸盐水平升高。大多数患者在甲状腺手术期间损伤,或意外切除甲状旁腺后发生此疾病。
之前所公布的随机双盲、含安慰剂对照的3期临床试验中,共有82位慢性甲状旁腺功能减退成人患者入组。结果显示,接受palopegteriparatide治疗的患者中,78.7%的患者实现不依赖常规治疗,保持血清钙水平在正常范围内(8.3–10.6 mg/dL),在安慰剂组此数值仅有4.8%(p<0.0001)。此外,通过甲状旁腺功能减退患者体验量表(HPES)检测的患者身体症状和认知症状,均获得统计学显著减少。
活性成分:Seladelpar
适应症:原发性胆汁性肝硬化(PBC)
公司名称:吉利德科学(Gilead Sciences)
Seladelpar为一款在研、口服、潜在“first-in-class”的强效选择性过氧化物酶体增殖物活化受体δ(PPARδ)激动剂。PPARδ表达在肝脏的多种细胞类型中,临床前数据表明,它对调控胆汁酸合成、炎症、纤维化过程的多种基因有调节作用。该药物曾于2019年2月获得美国FDA授予突破性疗法认定,用以治疗PBC。
PBC是一种有潜在生命危险的肝脏自身免疫性疾病。由于免疫系统持续攻击胆管,胆汁流动受阻而淤积,毒性胆汁酸在肝内留存,可发展为肝纤维化、肝硬化和肝功能衰竭。今年6月初所公布的3期研究分析显示,接受seladelpar治疗的中度至重度PBC成人患者中,患者报告的瘙痒迅速且持久地减少。针对代偿性肝硬化受试者的亚群分析表明,这类患者的胆汁淤积和肝损伤标志物有临床意义的改善。
活性成分:Vorasidenib
适应症:IDH突变神经胶质瘤
公司名称:Servier
Vorasidenib是一款口服、具脑渗透性与选择性的在研双重抑制剂,可抑制突变的IDH1/2蛋白,为潜在“first-in-class”药物。该疗法曾获得美国FDA授予突破性疗法认定。
Vorasidenib上市申请的递交主要是基于INDIGO关键3期临床试验的结果,该试验在第二次预定中期分析时达到了盲法独立审评委员会(BIRC)所评估的无进展生存期(PFS)主要终点和下次干预时间(TTNI)的关键次要终点。由BIRC评估的PFS分析显示,vorasidenib组和安慰剂组患者的PFS分别为27.7个月和11.1个月,试验达主要终点,两者差异具有统计学显著性和临床意义(HR=0.39;95% CI:0.27-0.56;单侧P=0.000000067)。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..