7月27日,中国国家药监局药品审评中心(CDE)官网公示,罗氏(Roche)申请的阿替利珠单抗注射液(皮下注射)上市申请已获得受理。公开资料显示,阿替利珠单抗是一款PD-L1抑制剂,此前已在全球范围内获批多项适应证。本次申报上市的为该产品的皮下注射剂型。根据罗氏此前公开新闻稿介绍,皮下给药阿替利珠单抗可将每次注射的治疗时间缩短至4~8分钟(一般为7分钟),而标准静脉输注则需要30-60分钟。
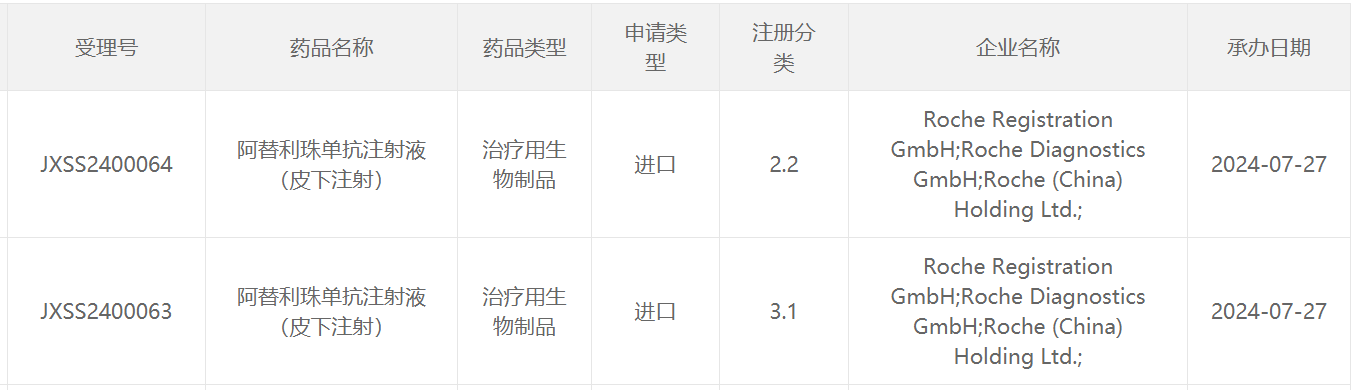
根据中国药物临床试验登记与信息公示平台官网,罗氏正在开展一项国际多中心(含中国)1b/3期临床研究(IMscin001研究),旨在既往接受过治疗的局部晚期或转移性非小细胞肺癌患者中研究皮下注射阿替利珠单抗相比静脉注射阿替利珠单抗的药代动力学、疗效和安全性。
该研究针对的受试者为未暴露于癌症免疫疗法(CIT)(即CIT初治)且既往接受过铂类药物为主的治疗失败的局部晚期或转移性非小细胞肺癌患者。在该研究中,阿替利珠单抗注射液的给药方法为皮下注射,每三周一次。研究拟在中国入组58人,在国际范围内已入组371人。
罗氏此前已经宣布IMscin001研究达到了其共同主要终点。该研究表明,在未接受过癌症免疫治疗的铂类治疗失败的局部晚期或转移性非小细胞肺癌(NSCLC)患者中,与静脉(IV)输注相比,皮下注射阿替利珠单抗在血液中的水平(药代动力学)显示出非劣效性。
2023年8月,罗氏宣布,基于1b/3期临床研究IMscin001研究,皮下注射阿替利珠单抗获得英国药品和医疗产品监管署(MHRA)批准上市,用于阿替利珠单抗静脉制剂之前已获批的所有适应症(包括某些类型的肺癌、膀胱癌、乳腺癌和肝癌)。这次批准是皮下注射阿替利珠单抗首次在全球获得监管单位批准。2023年11月,罗氏宣布欧洲药品管理局人用药品委员会(CHMP)建议批准皮下注射阿替利珠单抗上市申请,用于之前已批准的阿替利珠单抗静脉注射的所有适应症。
本次,皮下注射阿替利珠单抗在中国申请上市,意味着该产品的皮下注射剂型也有望在不久的将来惠及中国患者。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..