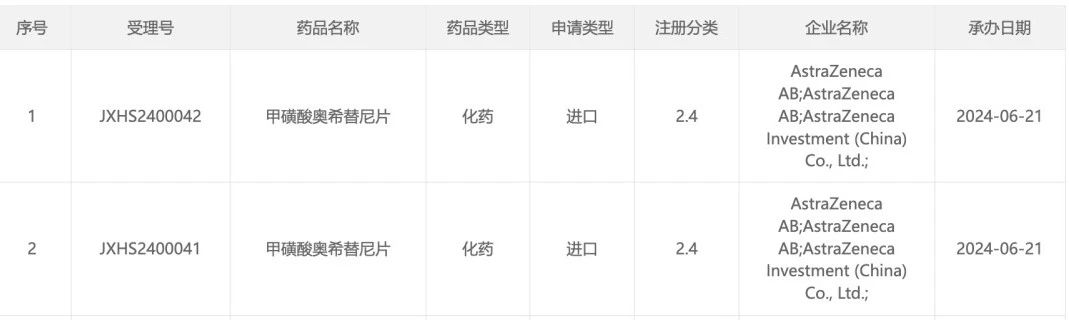
2024 ASCO 年会上,阿斯利康公布了 III 期临床 LAURA 研究数据,结果表明,与放化疗后接受安慰剂相比,在具有 EGFR 外显子 19 缺失或外显子 21(L858R)置换突变的 III 期不可切除 NSCLC 患者中,奥希替尼显示出统计学意义以及临床意义的 PFS 改善。
安全性和因不良事件 (AEs) 导致的停药率与预估的一致,未发现新的安全性问题。奥希替尼组有 35% 的患者出现各种原因导致的大于等于 3 级不良事件,安慰剂组这一比例为 12%。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..