6 月 3 日,根据 CDE 官网公示,诺诚健华申报的注射用坦昔妥单抗(Tafasitamab)拟纳入优先审评,拟定适应症为联合来那度胺用于治疗复发或难治性且不适合自体干细胞移植(ASCT)的弥漫性大 B 细胞淋巴瘤(DLBCL)成人患者。
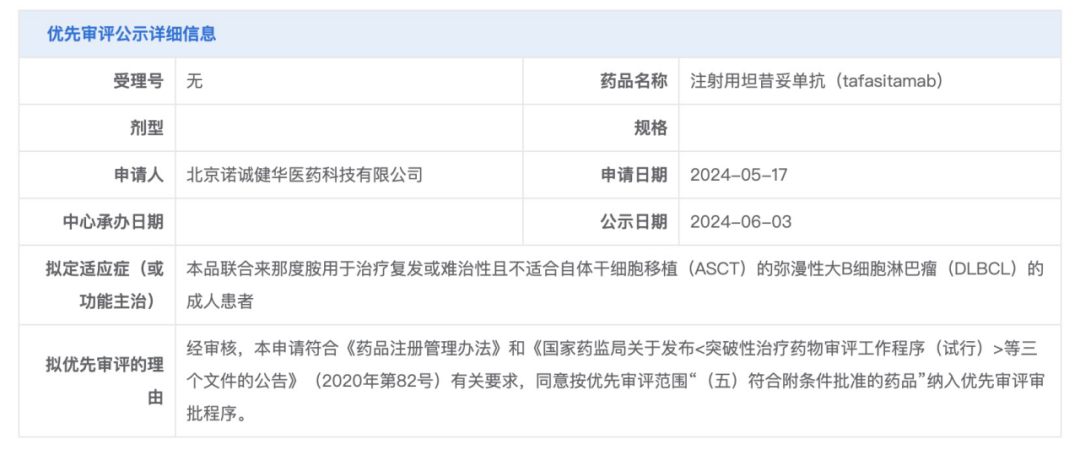
截图来自:CDE 官网
DLBCL 是一种源于成熟 B 细胞的侵袭性肿瘤,是最常见的非霍奇金淋巴瘤(NHL)类型,约占全部 NHL 的 25%~50%。该类血液肿瘤具有高度异质性特征,即不同 DLBCL 患者的生物学特征、病理形态、临床表现以及预后影响因素都有所不同,导致该疾病具有「同病不同命」的特点。
Tafasitamab 是一种靶向 CD19 的人源化单克隆抗体,其包含独有的工程化 Fc 结构域,因此强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导 B 细胞肿瘤的裂解。
2020 年 7 月和 2021 年 8 月,Tafasitamab 分别获得 FDA 以及 EMA 有条件批准与来那度胺联合治疗不适合 ASCT 的复发/难治性 DLBCL 患者。
2023 年 11 月,Tafasitamab 纳入 2024 年度「北京普惠健康保」海外特药目录保障范围,以惠及 DLBCL 患者。据诺诚健华官网显示,Tafasitamab 已经纳入了中国 30 多个省市的海外特药医保目录。
2024 年 1 月,Tafasitamab 联合来那度胺获得广东省药品监督管理局批准,在大湾区用于治疗不适合 ASCT 的复发/难治性 DLBCL 成人患者。
临床试验方面,2023 年美国癌症研究协会(AACR)年会上公布了 2 期研究 L-MIND 的最终五年随访数据,为我们展示了复发/难治性 DLBCL 患者接受 Tafasitamab 联合来那度胺治疗的长期疗效和安全性。
在对截至 2022 年 11 月 14 日的所有数据分析后,研究发现患者的 ORR 为 57.5%,其中 CR 为 41.2%,PR 为 16.2%。另外,中位随访期为 44 个月,中位 DOR 尚未达到。中位总生存期为 33.5 个月,中位无进展生存期为 11.6 个月。
在随访时间超过 60 个月的 21 名患者中,14 名患者接受过一次前线治疗,7 名患者接受过两次以上的前线治疗。对于接受过一次前线治疗的 40 名患者,其 ORR 更高,达到 67.5%(包括 CR 率 52.5% 和 PR 率 15%)。研究没有发现新的安全事件,在联合治疗和单药治疗期间,大多数 AE 均为 1 级或 2 级。
新公布的五年 L-MIND 数据验证了 Tafasitamab 联合来那度胺有潜力为某些复发/难治性 DLBCL 患者提供长期有效的缓解。另外,此联合用药方案治疗复发/难治性 DLBCL 已获得中国临床肿瘤学会(CSCO)临床诊疗指南推荐,再次表明该策略的可行性。
目前,Tafasitamab 联合来那度胺治疗复发/难治性 DLBCL 患者的 II 期临床研究在中国已经完成患者入组(登记号:CTR20221519)。此外,一项评估 Tafasitamab 和来那度胺联合吉西他滨和奥沙利铂对比利妥昔单抗联合吉西他滨和奥沙利铂治疗复发/难治性 DLBCL 患者的有效性和安全性的随机、多中心、III 期临床研究也于今年 4 月进行了公示(登记号:CTR20241368)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..